原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体具有结构相似的特征,下列各对粒子中,空间结构相似的是
①CS2与NO2 ②CO2与N2O ③SO2与O3 ④PCl3与BF3
| A.①②③ | B.③④ | C.②③④ | D.②③ |
下列对一些实验事实的理论解释正确的是
| 选项 |
实 验 事 实 |
理 论 解 释 |
| A. |
SO2溶于水形成的溶液能导电 |
SO2是电解质 |
| B. |
白磷为正四面体分子 |
白磷分子中P-P间的键角是109°28′ |
| C. |
1体积水可以溶解700体积氨气 |
氨是极性分子且由于有氢键的影响 |
| D. |
HF的沸点高于HCl |
H-F的键长比H-Cl的键长短 |
A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是
A.C元素的最高正价为+7价
B.原子半径:A>B>C
C.离子半径:A2->C->B2+
D.还原性:A2-<C-
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
| X |
Y |
|
| |
Z |
W |
请回答下列问题:
(1)W位于周期表中第__________周期,第________族;
(2)X可形成双原子分子,其分子的电子式是___________;Y和氢元素形成的10电子微粒中常见的+1价阳离子为_________(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为__________;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式______________________。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是_____________。
固体A的化学式为NH5,它的所有原子的最外层均满足2个或8个电子的稳定结构。则下列有关说法中错误的是
| A.1mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数的值) |
| B.NH5中既有共价键又有离子键 |
C.NH5的电子式为 |
| D.它与水反应的化学方程式为NH5+H2O═NH3•H2O+H2↑ |
下列表示氯及其化合物的化学用语正确的是
| A.中子数为20的氯原子符号:20Cl |
| B.HClO的结构式:H—Cl—O |
C.HClO4的电离方程式:HClO4 H++ClO4- H++ClO4- |
D.Cl-的结构示意图: |
有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同,下列事实不能说明上述观点的是
| A.苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 |
| B.乙烯能发生加成反应,乙烷不能发生加成反应 |
| C.甲苯能使酸性高锰酸钾溶液褪色,甲烷不能使酸性高锰酸钾溶液褪色 |
| D.苯与硝酸加热时发生取代反应,甲苯与硝酸常温下就能发生取代反应 |
研究下表信息可直接得出的结论是
| 元素 |
F |
Cl |
Br |
I |
| 氢化物组成 |
HF |
HCl |
HBr |
HI |
| 氢化物形成的难易程度 |
H2、F2混合,冷暗处剧烈化合并发生爆炸 |
H2、Cl2混合,光照或点燃时发生爆炸 |
H2、 Br2混合,加热时发生化合 |
H2、I2混合,加热化合,同时又分解 |
| 氢化物的热稳定性 |
很稳定 |
稳定 |
较稳定 |
较不稳定 |
A.同周期元素的金属性随原子序数递增而增强
B.同周期元素的非金属性随原子序数递增而增强
C.第ⅦA族元素的非金属性随电子层数的增加而减弱
D.第ⅦA族元素的金属性随电子层数增加而减弱
2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于 的说法正确的是
的说法正确的是
A. Pt和 Pt和 Pt的质量数不同,不能互称为同位素 Pt的质量数不同,不能互称为同位素 |
B. Pt和 Pt和 Pt的中子数相同,互称为同位素 Pt的中子数相同,互称为同位素 |
C. Pt和 Pt和 Pt的核外电子数相同,是同一种核素 Pt的核外电子数相同,是同一种核素 |
D. Pt和 Pt和 Pt的质子数相同,互称为同位素 Pt的质子数相同,互称为同位素 |
W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是
| A.阴离子的半径:Z>Y |
| B.气态氢化物稳定性:Z>Y>X |
| C.氧化物的水化物的酸性:Z>Y |
| D.元素W、X、Z各自最高和最低化合价的代数和分别为0、2、6 |
2015年4月,于敏获颁“影响世界华人终身成就奖”。“钚--239”是“于敏型”氢弹
的重要原料。下列说法正确的是
| A.239Pu原子的原子核中含有239个质子 |
| B.238Pu、239Pu和241Pu属于不同的核素 |
| C.238Pu与238U在元素周期表中的位置相同 |
| D.239Pu衰变成235U属于化学变化 |
据报道,月球上有大量 He存在,
He存在, He可以作为核聚变材料。下列关于
He可以作为核聚变材料。下列关于 He的叙述正确的是( )
He的叙述正确的是( )
A. He和 He和 H互为同位素 H互为同位素 |
B. He原子核内中子数为2 He原子核内中子数为2 |
C. He原子核外电子数为2 He原子核外电子数为2 |
D. He代表原子核内有2个质子和3个中子的氦原子 He代表原子核内有2个质子和3个中子的氦原子 |
下列化学用语或模型表示正确的是( )
| A.H2O2分子结构式:H一O一O一H |
B.氮气的电子式:N  N N |
C.Mg2+结构示意图: |
D.C2 H4分子比例模型: |
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。F原子核外最外层电子数与Na相同,其余各层电子均充满。
(1)E3+的价电子排布式为 。
(2)AB32— 的立体构型是 ,其中A原子的杂化轨道类型是 。
(3)A22— 与B22+ 互为等电子体,B22+的电子式可表示为 ___________,1mol B22+ 中含有的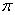 键数目为 。
键数目为 。
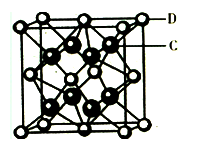
(4化合物DC2的晶胞结构如右图所示,形成的离子化合物的电子式为__________该离子化合物晶体的密度为a g/cm3,则晶胞的体积是 ____ cm3(只要求列算式,阿伏加德罗常数的值为NA)。