医用氯化钙 可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为:
可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为: 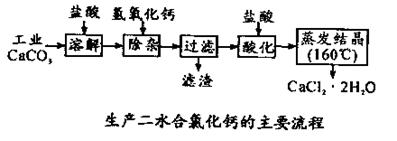
(1)CaCO3与盐酸反应的离子方程式 。
(2)过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。滤渣主要成分的化学式 。
(3)酸化时加盐酸的目的为:
① ,
②防止Ca2+ 在蒸发时发生水解。
(4)为什么蒸发 结晶要保持在160℃: 。
结晶要保持在160℃: 。
(5)为测定样品中CaCl2 ·2H2O的含量,称取0.7522g样品并配成250mL溶液,分别取该溶液25.00mL于三个锥形瓶中,用0.04mol/LAgNO3溶液进行三次滴定,消耗 AgNO3溶液的平均体积为20.39mL。
①通过计算,样品中含CaCl2 ·2H2O的质量分数 。
②若所测样品 CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为 。
。
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示: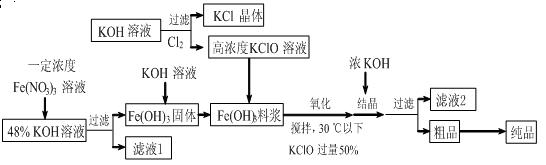
(1)上述氧化过程中,发生反应的离子方程式是: ,控制反应温度30℃以下的原因是: 。
(2)结晶过程中加入浓KOH溶液的作用是: 。
(3)根据图1、图2回答:为了获取更多的高铁酸钾,铁盐的质量分数应控制在 附近、反应时间应控制在 。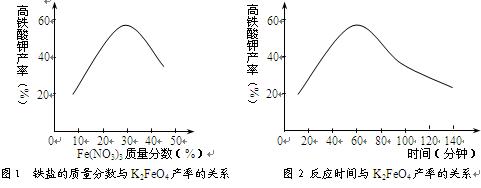
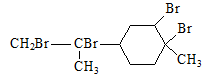
从柑橘中炼制萜二烯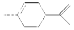 ,下列有关它的推测,不正确的是
,下列有关它的推测,不正确的是
| A.它不能使酸性高锰酸钾溶液褪色 |
| B.常温下为液态,难溶于水 |
| C.分子式为C10H16 |
| D.与过量的溴的CCl4溶液反应后产物如图 |
草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵【(NH4)2Fe(SO4)2·6H2O】晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是 ▲ 。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。
① 则A-B发生反应的化学方程式为: ▲ 。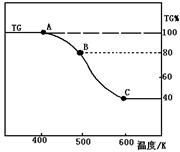
② 精确研究表明,B-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式: ▲ 、 ▲ ;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃.
的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸
亚铁锂的化学方程式为: ▲ 。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,
写出相应的电极反应式:
正极 ▲ 、负极 ▲ 。
下列说法中不正确的是 ( )
| A.新型无机非金属材料具有光学特性,具有生物功能、具有电学特性、能承受高温、强度高 |
| B.高温结构陶瓷与金属材料相比具有许多优点,如不怕氧化、密度小等优点 |
| C.光导纤维作为通讯材料有许多优点,但怕腐蚀,铺设也很不方便 |
| D.光导纤维除用于通讯外,还可以用于医疗、信息处理等许多方面 |
、联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:
⑴沉淀池中发生反应的化学方程式为_____________________;
⑵X是______,Y是______(填化学式);
⑶从理论上分析,在氨碱法生产过程中_______(填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 ;
⑷根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是____;
a.常温时氯化铵的溶解度比氯化钠小 b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
⑸相比于氨碱法,指出联碱法的一项优点______________。
碳化钛(TiC)、碳化硼(B4C3)、氮化硅(Si3N4)等非氧化物陶瓷是新型无机非金属材料,合成这些物质需在高温条件下进行,在合成它们的过程中必须注意 ( )
A.通入足量氧气 B.避免与氧气接触
C.通入少量氯气 D.通入少量氧气
化学选修:化学与技术分
鄂尔多斯市已探明煤炭储量1496亿多吨,约占全国总储量的1/6。煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题。
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为
FeS2 Fe2++SO42-
Fe2++SO42- Fe3+
Fe3+
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为________________,第二步反应的离子方程式为_________________________________________________。
(3)工业煤干馏得到的产品有焦炭、_____________________________________。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=___________,实际生产要将r值维持在1.7~2.2之间,原因是__________________________________________。
工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下:
(1)冷却过滤的目的是降低NaHSO4的 并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 。SO2的作用是作 剂。
(3)循环使用的物质是 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是 。
(5)工业上用铂作阳极、铜或银作阴极电解盐酸也可制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现) 。
钛白粉(主要成分是Ti02),覆盖能力强,折射率高,无毒,广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。下图是以钛铁矿(主要成分FeTi03,钛酸亚铁)为主要原料生产钛白粉的工艺流程图,回答下列问题: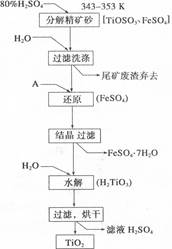
(1)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是 ;上述制备Ti02的过程中,所得到的副产物是 ,可回收利用的物质是:___________________。
(2)写出TiOS04溶液在加热条件下水解反应的离子方程式:
(3)为测定TiOS04的含量,首先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3Ti02+ +Al+6H+==3Ti3++AL3++3H20。过滤后,取出滤液20 mL,向其中滴加2~3滴KSCN溶液作指示剂,用酸式滴定管滴加0.1mol·L-1 FeCl3溶液,当溶液出现红色达到滴定终点,用去了30mL FeC13溶液。待测钛液中TiOS04的物质的量浓度是____________________。
草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是 。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。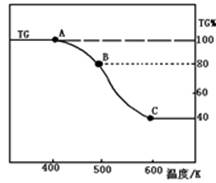
①则A-B发生反应的化学方程式为: 。
②精确研究表明,B-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式: 、
;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃. 的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸亚铁锂的化学方程式为: 。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,写出相应的电极反应式:
正极 、负极 。
化学与人类生产、生活密切相关,下列有关说法正确的是
| A.工业上用惰性电极电解熔融的MgO可制得Mg |
| B.为加快漂白精的漂白速率,使用时可滴加几滴醋酸 |
| C.草木灰可与铵态氮肥混合施用 |
| D.氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 |
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。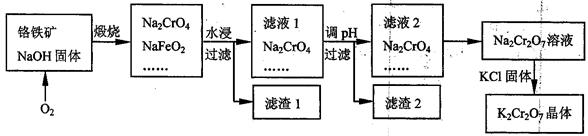 已知:①NaFeO2遇水强烈水解。②Cr2O72-+H2O
已知:①NaFeO2遇水强烈水解。②Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
请回答:
(1)K2Cr2O7中Cr元素的化合价是 。
(2)生成滤渣1中红褐色物质的反应的化学方程是 。
滤液1的成分除Na2CrO4外,还含有(填化学式) 。
(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是 。
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是 。
(5)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。