Ni元素化合物在生活中有非常重要的应用。纳米NiO可以制备超级电容器,NiOOH是制作二次电池的重要材料。现以NiSO4为原料生产纳米NiO和NiOOH流程如下:

(1)制备NiOOH过程中,NiSO4溶液配制方法__________________;过滤、洗涤后,得到Ni(OH)2固体,如何证明Ni(OH)2已经完全洗净______________;NaClO氧化Ni(OH)2的离子方程式为_________________。
(2) 已知Ksp[Ni(OH)2] = 2×10-15。室温下,欲加入一定量 NaOH固体使1L 含有0.001 mol·L-1的NiSO4和0.0001 mol·L-1的H2SO4溶液中残留c(Ni2+)≤2×10-7 mol·L-1,并恢复至室温,所加入的NaOH的固体质量至少为________g。
(3)NH3·H2O的浓度对纳米NiO的产率产生很大影响。右图为NiSO4的物质的量一定时,不同的反应物配比对纳米氧化镍收率的影响。请解释反应物NH4HCO3 和NiSO4的物质的量比在2.5至4.0时,收率升高的原因__________________。
(4)制备纳米 NiO 时,加入一些可溶于水的有机物(如:吐温—80)能制得更优质的纳米材料,原因是__________________。
(5)沉降体积是超细粉体的一个重要参数,若颗粒在液相中分散性好,则沉降体积较小;若颗粒分散性较差,则易引起絮凝沉降体积较大。右图是吐温—80 的加入量与前体在液体石蜡中沉降体积的关系曲线。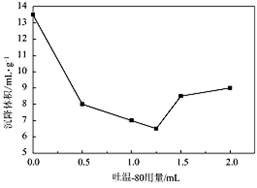
通过右图分析,吐温—80的最佳加入量为__________mL。
(6)NiOOH是制备镍镉电池的原料,某镍镉电池的总反应为
Cd+2NiOOH + 2H2O Cd(OH)2+ 2Ni(OH)2
Cd(OH)2+ 2Ni(OH)2
该电池放电时正极电极反应式为______________________________。
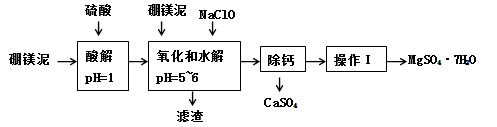
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
已知:某些氢氧化物沉淀的pH如下表所示:
| 氢氧化物 |
开始沉淀时的pH |
完全沉淀时的pH |
| Mg(OH)2 |
9.3 |
10.8 |
| Fe(OH)2 |
7.6 |
9.6 |
| Fe(OH)3 |
2.7 |
3.7 |
| Al(OH)3 |
3.7 |
4.7 |
根据题意回答第(1)~(6)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:______、_____。
(2)加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O = MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为 。
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(4)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩, 。“操作I”是将滤液继续蒸发浓缩,冷却结晶, ,便得到了MgSO4·7H2O。
(5)实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,计算MgSO4·7H2O的产率为 (保留两位有效数字)。
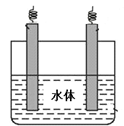
(6)金属镁可用于自然水体中铁件的电化学防腐,完成下图防腐示意图,并作相应标注。
锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4)含Al2O3、SiO2、Fe2O3等杂质,碱熔法生产锆的流程如下:

已知25℃时部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 |
Zr(OH)4 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
| 开始沉淀时pH |
1.2 |
2.7 |
3.4 |
6.3 |
| 完全沉淀时pH |
2.4 |
3.2 |
5.2 |
9.7 |
(1)完成高温熔融时的主要反应方程式:ZrSiO4 + 4NaOH = Na2ZrO3 + +
(2)为了提高浸出率可采取的方法有 、 (列举两种)
(3)生成滤渣2的成分 (用化学式表示)
(4)用氨水将滤液2的pH调至 ≤pH< ,目的是 。
(5)往流程中滤渣1中加入盐酸溶液,过滤不溶物后,再将滤液在不断通入 气流同时蒸发结晶,可回收得到铁的氯化物FeCl3晶体。
[化学—选修2:化学与技术]银、铜均属于重金属,从银铜合金废料中回收银并制备含铜化合物产品的工艺如图所示: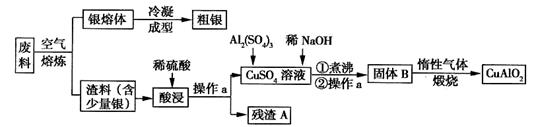
(1)熔炼时被氧化的元素是 ,酸浸时反应的离子方程式为 。为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进行处理,其处理方法是 。
(2)操作a是 ,固体B转化为CuAlO2的过程中,存在如下反应,请填写空白处:
CuO+ Al2O3 + ↑。
+ ↑。
(3)若残渣A中含有n mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的化学方程式 。为彻底消除污染,可将反应中产生的气体与V L(标准状况)空气混合通入水中,则V至少为 L(设空气中氧气的体积分数为0.2)。
(4)已知2Cu+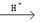 Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点 。
Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点 。
(5)假设粗银中的杂质只有少量的铜,利用电化学方法对其进行精炼,则粗银应与电源的 极相连,当两个电极上质量变化值相差30.4g时,则两个电极上银质量的变化值相差 g。
镍是有机合成的重要催化剂,某化工厂有含镍催化剂废品(主要成分是镍、杂质是铁、铝单质及其化合物,还有少量难溶性杂质)。某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 |
开始沉淀 |
完全沉淀 |
| Al(OH)3 |
3.8 |
5.2 |
| Fe(OH)3 |
2.7 |
3.2 |
| Fe(OH)2 |
7.6 |
9.7 |
| Ni(OH)2 |
7.1 |
9.2 |
回答下列问题:
(1)溶液①中含金属元素的离子是_________________。
(2)用离子方程式表示加入双氧水的目的___________;双氧水可以用下列物质替代的是_______。
A.氧气 B.漂白液 C.氯气 D.硝酸
(3)操作a和c需要共同的玻璃仪器是_____________;操作C的名称是______________。
(4)如果加入双氧水量不足或“保温时间较短”,则所制备的产品可能含有的杂质为_____________;请选择合适的试剂,设计实验证明产品中是否含“杂质” ______________。
(5)含镍金属氢化物MH-Ni燃料电池是一种绝色环保电池,广泛应用于电动汽车。其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M  MHx+xNiOOH;电池充电过程中阳极的电极反应式为_____________,放电时负极的电极反应式为___________。
MHx+xNiOOH;电池充电过程中阳极的电极反应式为_____________,放电时负极的电极反应式为___________。
(10分)碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程。
(1)氟碳酸铈的化学式为为CeFCO3,该化合物中,Ce的化合价为 。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为 。
(3)试剂X是 。
(4)若试剂X改为氢氧化钠溶液,则反应生成难溶物—一氢氧化铈(Ⅲ),其暴露于空气中时变成紫色,最终变成黄色的氢氧化高铈(Ⅳ)。氢氧化铈在空气中被氧化成氢氧化高铈的化学方程式为 。
(5)取(4)中得到的Ce(OH)4产品(质量分数为97%)1.00 g,加硫酸溶解后,用0.1000mol·L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+),则需要滴加标准溶液的体积为 mL。
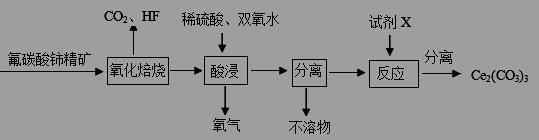
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质②四种化合物的溶解度(S)随温度(T)
变化曲线如图所示。
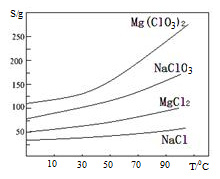
回答下列问题:
(1)过滤时主要的玻璃仪器有
(2)加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是
(3)加速卤块在H2O2溶液中溶解的措施有: (写出一条即可)
(4)加入MgO的作用是 ;滤渣的主要成分为
(5)向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为:MgCl2+2NaClO3= Mg(ClO3)2↓+2NaCl,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(6)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2: 取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.l000 mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ +6Fe3++7H2O。
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式(还原产物为Cl-)
②产品中Mg(ClO3)2·6H2O的质量分数为(保留一位小数)
七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣﹣硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4•7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 .
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 .
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的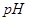 见下表:(金属离子浓度为:0.01mol/L)
见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至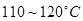 时,失去结晶生成无水氯化钴。
时,失去结晶生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为 ,加入萃取剂的目的是 。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ、ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)②中使用的氧化剂最好是下列的 (选填字母代号)。
| A.Cl2 | B.浓HNO3 | C.KMnO4 | D.H2O2 |
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤 (选填①、②、③、⑤)。
(3)写出步骤④后产生滤渣3的化学式 。
(4)与Al相似,Zn也能溶于NaOH溶液。写出将Zn片和Cu片放入NaOH溶液中形成原电池的负极电极反应式: 。
Ⅱ、BaS溶液的制备:
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH1=-1473.2 kJ·mol-1
C(s)+ O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
Ba(s)+S(s)=BaS(s) ΔH3=-460 kJ·mol-1
(5)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为: 。
Ⅲ、制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是 。
【化学──化学与技术】硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下: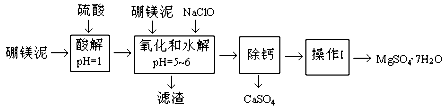
根据题意回答第(1)~(6)题:
(1)实验中需用1mol/L的硫酸800 mL,若用98%的浓硫酸(ρ=" 1.84" g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
| A.10 mL | B.20 mL | C.50 mL | D.100 mL |
(2)加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O = MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 。
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 。“操作I”是将滤液继续蒸发浓缩,冷却结晶, ,便得到了MgSO4·7H2O。
(6)实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,则MgSO4·7H2O的产率为 。
[化学—选修(二)化学与技术]常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
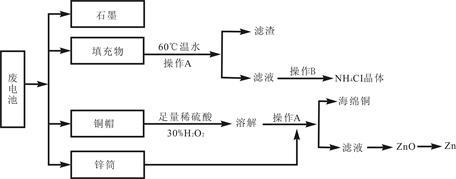
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率 。
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强。
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2)中钒的主要流程如下:
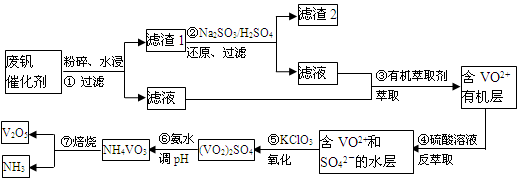
已知:(1)V2O5和NH4VO3均为难溶物,VOSO4和(VO2)2SO4均为易溶物。
(2) VO2++H2C2O4+H+ → VO2+ + CO2↑+ H2O
回答下列问题:
(1)步骤②的目的是 。
(2)步骤③的变化过程可简化为(HA表示有机萃取剂):
VOSO4 (水层)+ 2HA(有机层) VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是 。
VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是 。
(3)若ClO3-将被还原为Cl-,请写出骤⑤中发生反应的离子方程式为 。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定操作⑤后溶液中含钒量的步骤为:取10.0mL0.1mol/LH2C2O4溶液于锥形瓶中,加入指标剂,将待测液盛放在滴定管中,滴定到终点时,消耗待测液的体积为10.00mL,由此可知(VO2)2SO4溶液钒元素的含量为 g/L。
(5)V2O5可用金属(如Ca、Al)热还原法获得钒,则金属铝热还原制得钒的化学方程式为 。
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
 温度/℃ 温度/℃化合物 |
0 |
20 |
40 |
60 |
80 |
100 |
| NH4Cl |
29.3 |
37.2 |
45.8 |
55.3 |
65.6 |
77.3 |
| ZnCl2 |
343 |
395 |
452 |
488 |
541 |
614 |
| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
碱式碳酸铜[CuCO3·Cu(OH)2]是一种用途广泛的化工原料,可用于作有机催化剂、颜料制造、原油贮存时脱碱等。用废杂铜(主要成分为Cu,还含有少量杂质Fe)制取碱式碳酸铜的工艺流程如图所示。
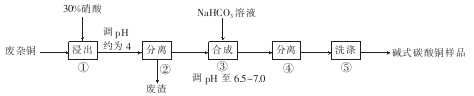
(1)步骤①浸出时,硝酸浓度不易过大,其原因是____。
(2)步骤②分离前需将溶液pH调节在4左右,其目的是 ,所得废渣的主要成分为____________。
(3)步骤③合成时,采用将NaHCO3溶液迅速投入Cu(NO3)2溶液中,其主要原因是 ;合成时发生反应的化学方程式为____________。
(4)本实验中两次用到固液分离,本实验中最适合固液分离的设备是____________。
(5)步骤⑤洗涤主要除去的杂质离子是 。
(6)准确称取所得产品m g,放入碘量瓶中,加入2 g KI及5 ml3 mol/L稀硫酸(两试剂均过量)摇匀并静置10 min(2Cu2++4I-=2CuI↓+I2),再加入2 mL淀粉溶液,用c mol/L的Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),到滴定终点时消耗Na2S2O3标准溶液V mL,则样品中铜元素的质量分数为________。