(16分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,该水解反应的化学方程式为 。再经过滤、水洗除去其中的Cl–,再烘干、焙烧除去水分得到粉体TiO2。检验TiO2·xH2O中Cl–是否被除净的方法是 。
(2)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是 ;
②滴定终点的现象是 。
③滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为 。
④下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果 。
若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果 。
下列物质属于复合材料的是
| A.普通玻璃 | B.普通钢 | C.玻璃钢 | D.镁铝合金 |
丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下:
| 序号 |
n(丙酸)∶ n(碱式碳酸锌) |
反应温度/℃ |
丙酸锌产率/% |
| 1 |
1∶0.25 |
60 |
67.2 |
| 2 |
1∶0.25 |
80 |
83.5 |
| 3 |
1∶0.25 |
100 |
81.4 |
| 4 |
1∶0.31 |
60 |
89.2 |
| 5 |
1∶0.31 |
80 |
90.1 |
| 6 |
1∶0.31 |
100 |
88.8 |
(1)探究本实验中最佳工艺条件(见上表):反应时间2 h,用水量45 g,n(丙酸)∶n(碱式碳酸锌)=1∶ ,反应温度 ℃。
,反应温度 ℃。
(2)本工艺采用“闭路循环”方式,除具有制备工艺简便、产率高外,还具有 的优点。
(3)某次实验时,将37.0 g丙酸溶于220 mL水中,按上述流程在上述优化的条件下制备,最终得丙酸锌49.6 g,则该次实验丙酸锌的产率为 (写出计算过程)。
下列关于物质用途的叙述中不正确的是
| A.工业上利用蛋白质的水解反应生产肥皂和甘油 |
| B.从石油中获得乙烯是工业生产乙烯的主要途径 |
| C.通过海水可以制取氯化钠、镁、烧碱等物质 |
| D.晶体硅是良好的半导体材料,可制成光电池等 |
化学与社会、生活和生产息息相关,以下叙述错误的是
| A.科学家们正在研究利用蓝绿藻等低等植物和微生物在阳光作用下使水分解产生氢气 |
| B.贮氢金属在一定温度和压强下可以吸附氢气,如镧镍合金(LaNi5)可以吸附氢气形成LaNi5H6,其中H元素仍以H2分子形式存在 |
| C.生活垃圾送入焚烧炉产生的热量可发电、供暖,焚烧炉产生的气体不可直接排放 |
| D.2013年3月底,H7N9型禽流感在上海和安徽两地率先发现。要杀死禽流感病毒可通过消毒剂杀菌,通过加热煮沸杀菌,也可用紫外线照射杀菌。 |
我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

沉淀池中四种盐在不同温度下的溶解度(g / 100 g水)表
 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
| NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
| NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
| NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
| NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)沉淀池中反应温度控制在30℃~35℃,是因为若高于35℃,则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为 。
(2) 沉淀池中发生的化学反应方程式是 。
(3)副产品的一种用途为 ,写出上述流程中X物质的分子式 。
(4)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(5) 为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
许多国家十分重视海水资源的综合利用。不需要化学变化就能从海水中获得的物质是
| A.氯、溴、碘 | B.钠、镁、铝 |
| C.食盐、淡水 | D.烧碱、氢气 |
下列制品与材料类别不对应的是
| A |
B |
C |
D |
||
 玻璃 |

|
 不锈钢 |
 玻璃钢 |
||
| 无机非金属材料 |
有机高分子材料 |
金属材料 |
复合材料 |
下列问题处理的过程中主要发生化学变化的是
| A.通过水解将“地沟油”制成肥皂 | B.用多孔吸附剂淸除海面上泄漏的原油 |
| C.把放射性核废料深埋于地下岩层 | D.用蒸馏方法从食盐水中获得纯净水 |
下列有关合成洗涤剂的叙述错误的是
| A.在洗涤剂烷基苯磺酸钠中,烷基含碳原子的个数以12~18为宜 |
| B.在洗涤剂烷基苯磺酸钠中,烷基应以带有支链的为宜 |
| C.在合成洗涤剂中添加酶制剂可提高洗涤效果 |
| D.在合成洗涤剂中应以无磷助剂代替含磷助剂 |
化学选修:化学与技术分
鄂尔多斯市已探明煤炭储量1496亿多吨,约占全国总储量的1/6。煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题。
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为
FeS2 Fe2++SO42-
Fe2++SO42- Fe3+
Fe3+
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为________________,第二步反应的离子方程式为_________________________________________________。
(3)工业煤干馏得到的产品有焦炭、_____________________________________。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=___________,实际生产要将r值维持在1.7~2.2之间,原因是__________________________________________。
下列有关生铁炼钢的叙述错误的是( )。
| A.添加必要的元素,改善钢材的组织结构和性能 |
| B.适当降低生铁中的含碳量,除去大部分硫、磷等杂质 |
| C.加入硅、锰、铝等合金元素调整成分并脱去钢水中的氧 |
| D.除去生铁中的非金属元素 |
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: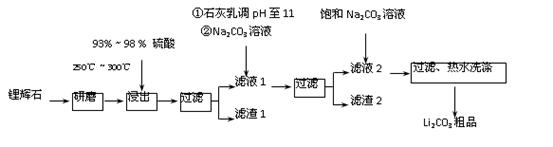
已知:①Li2O·Al2O3·4SiO2 +H2SO4(浓) Li2SO4+Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示。
| T/℃ |
20 |
40 |
60 |
80 |
| S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是 。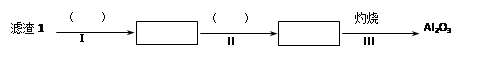
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。
向滤液1中加入石灰乳的作用是(运用化学平衡移动原理解释) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
① a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。