对下列事实的解释错误的是
| A.氨溶于水的喷泉实验,说明氨气极易溶于水 |
| B.常温下,浓硝酸可用铝罐来贮存,说明浓硝酸具有强氧化性 |
| C.向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性 |
| D.氯气可使湿润的红色布条褪色,而不能使干燥的有色布条褪色,说明次氯酸具有漂白性 |
下列说法正确的是 ( )。
| A.实验室可用加热分解碳酸钙的方法制取二氧化碳气体 |
| B.二氧化硫易溶于水,硫酸工厂的尾气可以直接用水吸收 |
| C.二氧化氮可与水反应而被吸收,故硝酸工业的尾气应该用水吸收 |
| D.配制较高浓度的碘水时,应先将碘溶于酒精中,再加水稀释 |
硫酸、硝酸和盐酸既是重要的化工原料也是化学实验室里必备的试剂。
(1)常温下,可用铝槽车装运浓硫酸,这是因为浓硫酸具有 性;硝酸应保存在棕色试剂瓶中,这是因为硝酸具有 性;敞口放置的浓盐酸浓度会减小,这是因为盐酸具有 性。
(2)①在100 mL 18 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积为13.44 L,则参加反应的铜片的质量为 (选填序号);
a.115.2 g b.76.8 g c.57.6 g d.38.4 g
②若使上述①中反应剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式: 。
(3)工业制盐酸是以电解饱和氯化钠溶液为基础进行的,该电解过程中阳极的电极反应式为: 。
今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
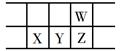
| A. |
原子半径:W<X |
B. |
常温常压下,Y单质为固态 |
| C. |
气态氢化物热稳定性:Z<W |
D. |
X的最高价氧化物的水化物是强碱 |
C、N、S都是重要的非金属元素,以下分析正确的是
A.三者对应的氧化物均为酸性氧化物
B.三者的单质直接与氧气反应都能生成两种以上氧化物
C.同温度、同浓度的Na2CO3、NaNO3、Na2SO3溶液的PH:NaNO3< Na2SO3< Na2CO3
D.CO2、NO2、SO2都能与H2O反应,其反应类型相同
下列有关元素及其化合物知识的说法中正确的是( )
| A.浓硝酸能与木炭反应,证明浓硝酸既具有强氧化性又具有强酸性 |
| B.溴中溶有少量氯气,可用先加入少量溴化钠溶液再用酒精萃取的方法提纯 |
| C.高温下SiO2与Na2CO3反应生成Na2SiO3和CO2,证明硅酸酸性强于碳酸 |
| D.铵盐受热都能分解,但不一定都能生成氨气 |
以下是对重要非金属及其化合物的讨论,根据要求回答问题:
(1)实验室盛装NaOH溶液是试剂瓶不能用玻璃塞,应该用橡胶塞,以防止发生反应:
(离子方程式)。
(2)氨是一种重要的化工产品,密度比空气 (填“大”或“小”)。工业上制备氨气的化学方程式为 。
(3)工业上制取漂白粉的反应化学方程式为 。
(4)浓H2SO4常用作气体干燥剂,是因为它具有____________;将适量的蔗糖放入烧杯中,滴入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
产生刺激性气味气体的化学方程式为 。
(5)铜和稀硝酸反应的离子方程式是 。若参加反应的Cu质量为6.4g,生成NO气体____________L(标准状况下),则转移电子物质的量为 mol,被还原的与未被还原的HNO3物质的量之比为 。
下列化学物质在实际生产生活和科技等方面的应用不正确的是 ( )。
| A.测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热 |
| B.石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料 |
| C.因为氨易液化,液氨在气化时会吸收大量的热量,所以液氨可作制冷剂 |
| D.硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药 |
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种。若该气体为无色气体,且通过品红溶液后,品红溶液褪色,剩余气体与空气接触时,很快变为红棕色。下列判断正确的是
| A.肯定只有NO | B.肯定有SO2和O2 |
| C.可能有Cl2和O2 | D.肯定没有Cl2、O2和NO2 |
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是 ( )。
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
SO2有漂白性 |
SO2可使溴水褪色 |
| B |
SiO2有导电性 |
SiO2可用于制备光导纤维 |
| C |
浓硫酸有强氧化性 |
浓硫酸可用于干燥H2和CO |
| D |
Fe3+有氧化性 |
FeCl3溶液可用于回收废旧电路板中的铜 |
短 周期元素 W 、 X 、 Y 和 Z 在 周期表中的相对位置如 表 所示,这四种元素原子的最外层电子数之和为 21 。 下 列 关系正确 的 是( )
| A. |
氢化物沸点: |
B. |
氧化物对应水化物的酸性: |
| C. |
化合物熔点: · |
D. |
简单离子的半径: |
W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是( )
| A. |
原子半径大小为W<X<Y<Z |
B. |
X的氢化物水溶液酸性强于Z的 |
| C. |
Y 2W 2与ZW 2均含有非极性共价键 |
D. |
标准状况下W的单质状态与X的相同 |
下列说法正确的是( )。
| A.打开盛浓盐酸的试剂瓶可看到白色的雾,这说明HCl不稳定 |
| B.蔗糖中滴入浓硫酸,蔗糖变黑,这说明浓硫酸是氧化性酸 |
| C.胆矾晶体中滴入浓硫酸,胆矾由蓝色变为白色,这说明浓硫酸有脱水性 |
| D.碳酸、亚硫酸和次氯酸都是不稳定性酸 |
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 |
甲 |
乙 |
丙 |
| ① |
CO2 |
SO2 |
石灰水 |
| ② |
HCl |
CO2 |
石灰水 |
| ③ |
CO2 |
SO2 |
Ba(NO3)2 |
| ④ |
NO2 |
SO2 |
BaCl2 |
| ⑤ |
CO2 |
NH3 |
CaCl2 |
A.①②③④ B.②③④⑤ C.①③④ D.②③④