[山东]2014届山东省济南市高三上学期期末考试化学试卷
化学与生活、社会密切相关。下列有关说法中,错误的是
| A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B.凡含有食品添加剂的食物对人体健康均有害,均不可食用 |
| C.为防止电池中的重金属污染土壤和水体,应积极开发废电池的综合利用 |
| D.提倡人们购物时尽量不用塑料袋,是为了减少白色污染 |
下列有关物质应用的说法中,正确的是
| A.用石英器皿盛装氢氟酸 |
| B.臭氧具有强还原性,可用于自来水的杀菌消毒 |
| C.Fe3+具有氧化性,可腐蚀印刷线路板上的铜 |
| D.硫酸钡俗称“钡餐”,可用于治疗胃酸过多 |
2012年,IUPAC正式命名了116号元素,下列关于 和
和 的说法中,错误的是
的说法中,错误的是
| A.这是两种原子 |
| B.两者电子数相差1 |
| C.两种原子中中子数分别为177和175 |
| D.两者互为同位素 |
用下列分离装置进行相应实验,能达到相应实验目的的是
| A.用图Ⅰ所示装置除去CO2中含有的少量HCl |
| B.用图Ⅱ所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图Ⅲ所示装置分离NaCl和Na2SO4的混合溶液 |
| D.用图Ⅳ所示装置分离CCl4萃取碘水中的碘后已分层的有机层和水层 |
NA表示阿伏加德罗常数的值。下列说法中,正确的是
| A.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA |
| B.电解精炼铜时,当电路中转移NA个电子,阳极溶解32 g铜 |
| C.向仅含0.2 mol FeI2的溶液中持续通入氯气,当有0.1 mol Fe2+被氧化时,转移电子的数目为0.5NA |
| D.将100 mL 0.1 mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.在0.1 mol·L-1 NaOH溶液中:K+、Na+、SO42-、HCO3- |
| B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、Ba2+、NO3-、Cl- |
| C.在0.1 mol·L-1 FeCl3溶液中:K+、NH4+、I-、SCN- |
| D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3- |
右表为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是
| A.常温常压下,五种元素的单质中有两种是气态 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物比X的氢化物稳定 |
| D.Y与W元素的最高价氧化物对应的水化物的酸性比较,前者弱于后者 |
下列有关物质分类或归类中,正确的是
①混合物:盐酸、漂白粉、氯水、水银 ②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、石膏、冰醋酸、氯化银 ④同素异形体:C60、C70、金刚石、石墨
| A.只有①③ | B.只有②③ | C.只有③④ | D.只有④ |
下列由相关实验现象所推断出的结论中,正确的是
| A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
| B.加热分别盛有氯化铵和碘的两支试管,试管底部固体均减少,说明二者均发生升华 |
| C.Fe与稀HNO3溶液、稀H2SO4溶液反应均有气泡产生,说明Fe与两种酸均发生置换反应 |
| D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
下列各组物质反应产生的气体分别通入Na2SO3溶液中,与Na2SO3不发生反应的是
①Na2O2和CO2 ②Al和NaOH溶液 ③MnO2和浓盐酸共热
④浓硝酸和铜片 ⑤铜片和浓硫酸共热
| A.只有② | B.只有①② | C.只有①②⑤ | D.只有②④⑤ |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,下列有关说法中,正确的是
A.当有0.1 mol电子转移时,a极产生1.12 L O2(标准状况下)
B.b极上发生的电极反应是:4H2O+4e-=2H2↑+4OH-
C.c极上发生的电极反应是:O2+4H++4e-=2H2O
D.d极上进行还原反应,产生的H+可以通过隔膜进入A
在25℃时,将0.1 mol·L-1的HA溶液与0.1 mol·L-1的NaOH溶液等体积混合后,测得混合溶液pH=8,则下列所表示的该混合溶液中有关微粒的浓度关系中,错误的是
A.c(HA)+c(A-)=c(Na+)=0.1 mol·L-1
B.c(Na+)-c(A-)=c(OH-)-c(H+)
C.c(Na+)>c(A-)>c(OH-)>c(H+)
D.c(OH-)=c(H+)+c(HA)
在25℃时,甲、乙两个烧杯中分别盛有1 L、pH均为2的盐酸和醋酸,现分别投入0.12 g镁粉充分反应,下列说法中,正确的是
| A.反应过程中,两个烧杯中产生氢气的速率一直相等 |
| B.反应结束后,两个烧杯中产生氢气的物质的量相等 |
| C.反应结束后,乙烧杯中有镁粉剩余 |
| D.反应结束后,甲烧杯中溶液呈中性 |
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g) 2C(g) ΔH>0,其他条件不变化,只有温度变化时,某量随温度变化的关系如图所示。则下列说法中,正确的是
2C(g) ΔH>0,其他条件不变化,只有温度变化时,某量随温度变化的关系如图所示。则下列说法中,正确的是
| A.若P1>P2,纵坐标表示A的质量分数 |
| B.若P1<P2,纵坐标表示C的质量分数 |
| C.若P1>P2,纵坐标表示混合气体的平均摩尔质量 |
| D.若P1<P2,纵坐标表示A的转化率 |
由已知电离常数判断,下列关于SO2与Na2CO3(aq)反应的离子方程式的书写中,不合理的是
| 酸 |
电离常数 |
| 碳酸 |
K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 |
K1=1.54×10-2 K2=1.02×10-7 |
A.SO2+H2O+2CO32-="2" HCO3-+SO32-
B.SO2+H2O+CO32-=H2CO3+SO32-
C.2SO2+2H2O+CO32-=H2CO3+2 HSO3-
D.SO2+H2O+CO32-= HCO3-+HSO3-
下列各组中的实验步骤及现象,能达到相应实验目的的是
| |
实验目的 |
实验步骤及现象 |
| A |
检验亚硫酸钠试样是否变质 |
试样  白色沉淀 白色沉淀 沉淀不溶解 沉淀不溶解 |
| B |
制取氯气并探究氯气是否具有漂白性 |
MnO2和稀盐酸 气体 气体 褪色 褪色 |
| C |
证明酸性条件H2O2氧化性比I2强 |
碘化钠溶液  溶液变蓝色 溶液变蓝色 |
| D |
探究浓度对于化学平衡的影响 |
FeCl3和KSCN混合溶液 红色变深 红色变深 |
铁和铝是生产和生活中最常见的两种金属,其单质和化合物被广泛应用。
(1)硫酸铁溶液可用于浸出黄铜矿精矿,其主要反应为:
CuFeS2+4Fe3+=Cu2++5Fe2++2S(CuFeS2中S为-2价,Fe为+2价)。
关于该反应,下列说法中,正确的是 (选填序号);
a.从物质分类的角度看,CuFeS2属于合金 b.反应过程中只有一种元素被还原
c.CuFeS2既作氧化剂又作还原剂 d.当转移1 mol电子时,产生16 g S
(2)高铁酸钾(K2FeO4)是一种新型水处理剂,在水中发生反应生成Fe(OH)3胶体。该反应中,高铁酸钾表现 (填“氧化性”或“还原性”),Fe(OH)3胶体具有净水作用,其原因是 。
(3)某同学取一张铝箔,并用针刺一些小孔,然后取一药匙过氧化钠粉末,用铝箔包好,放入右图所示装置内倒扣的漏斗中(图中铁架台和铁夹没有画出)。
按顺序写出该过程中发生反应的离子方程式:
① ;
② 。
硫酸、硝酸和盐酸既是重要的化工原料也是化学实验室里必备的试剂。
(1)常温下,可用铝槽车装运浓硫酸,这是因为浓硫酸具有 性;硝酸应保存在棕色试剂瓶中,这是因为硝酸具有 性;敞口放置的浓盐酸浓度会减小,这是因为盐酸具有 性。
(2)①在100 mL 18 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积为13.44 L,则参加反应的铜片的质量为 (选填序号);
a.115.2 g b.76.8 g c.57.6 g d.38.4 g
②若使上述①中反应剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式: 。
(3)工业制盐酸是以电解饱和氯化钠溶液为基础进行的,该电解过程中阳极的电极反应式为: 。
常温下,有浓度均为1 mol·L-1的下列4种溶液:
①H2SO4溶液 ②NaHCO3溶液 ③NH4Cl溶液 ④NaOH溶液
(1)这4种溶液pH由大到小的顺序是 ,其中由水电离的H+浓度最小的是 。(均填序号)
(2)②中各离子浓度由大到小的顺序是 ,NaHCO3的水解平衡常数Kh= mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)向③中通入少量氨气,此时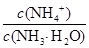 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积 ④的体积(填“大于”、“小于”或“等于”之一)。
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)上述3种气体直接排入空气后会引起酸雨的气体有 (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g) 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1
则SO2(g)+NO2(g) SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 ,理论上通过外电路的电子最多为 mol。
下图5个装置都是中学化学中常见的实验装置,某学习小组的同学欲用这些装置进行常见物质的制取并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题:
(1)将A、C、E相连后,以浓盐酸和 (填写名称)为原料制取Cl2,仪器乙的名称是 。
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将所得氯水滴入品红溶液 |
品红溶液褪色 |
氯气与水反应的产物有漂白性 |
| Ⅱ |
向所得氯水中加入碳酸氢钠粉末 |
有无色气泡产生 |
氯气与水反应至少产生一种酸性强于碳酸的物质 |
实验Ⅰ获得结论是否合理? (填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由): 。
实验Ⅱ获得结论是否合理? (填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由): 。
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱。则C中预期出现的现象是 。
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2。一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先 ,再 以使烧杯中的水进入试管丁,观察现象。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号