(11分)某中学高一化学兴趣小组的同学,在实验室探究用过量的锌与浓硫酸反应制取SO2。
①这样制取的SO2中可能含有的杂质有________。
②某同学用下列装置连接成一整套实验装置以验证①的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是______→______→______→______→______→(用a、b……填写;每套装置只允许使用一次)。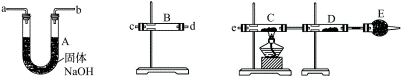
③根据②确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论填入下表:
| 装置 |
所盛药品 |
实验现象 |
结论 |
| B |
|
|
|
| C |
CuO固体 |
|
|
| D |
无水CuSO4 |
|
(12分)2009年2月3日下午,山西省太原市第四人民医院举行了祝贺太原禽流感患儿彭杰(女)康复出院及病情报告会。禽流感病毒是一种没有超常抵抗力的病毒。研究证明,许多常用消毒药品如漂粉精、漂白粉、高锰酸钾等,都可以将禽流感病毒杀灭。氯气及氢氧化钙充分反应,使次氯酸钙成为主要成分,得到漂粉精,其稳定性比漂白粉高。
将漂粉精溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的离子方程式为______________________________。另取少许上层清液,先滴加适量的________(填化学式)酸化,再滴加________(填化学式)溶液即可检验Cl-的存在,发生反应的离子方程式为____________________________。再取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂粉精溶液呈______性并具有______性。
对于反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,下列有关说法中不正确的是
| A.HNO3在反应中既表现氧化性也表现出酸性 |
| B.每生成22.4L NO(标准状况)有3mol电子转移 |
| C.HNO3作氧化剂,铜作还原剂,3molCu还原8 mol的HNO3 |
| D.HNO3作氧化剂,铜作还原剂,3molCu还原2 mol的HNO3 |
下列关于物质性质的叙述中,正确的是
| A.浓硫酸具有吸水性,能使胆矾晶体由蓝变白 |
| B.同温同物质的量浓度的Na2CO3溶液和NaHCO3溶液,前者的碱性弱 |
| C.过量铁粉加入CuCl2溶液中,充分反应后溶液中的阳离子主要是Fe3+ |
| D.硅是应用广泛的半导体材料,常温下易与氧气、氯气、硫酸等物质反应 |
下列物质露置于空气中易变质的是
①氯水 ②水玻璃 ③烧碱 ④漂白粉 ⑤绿矾 ⑥亚硫酸钠
| A.除⑤外 | B.除②③外 |
| C.除②③⑥外 | D.全部易变质 |
2008北京奥运会与2008北京残奥会奖牌采用“金镶玉”奖牌。经过国家有关部门认定,金镶玉奖牌中用的玉为透闪石玉(昆仑玉)。闪石是指具有宝石价值的硅酸盐矿物。大多数的玉其化学成分都属于硅酸盐,为了研究方便,将它们的化学式用盐或氧化物的形式表示,据此,下列说法不正确的是
| A.钙沸石Ca(Al2Si3O10)·3H2O可表示为:CaO·Al2O3·3SiO2·3H2O |
| B.正长石KAlSi3O8可表示为:K2O·Al2O3·6SiO2 |
| C.透闪石玉Ca2Mg5Si8O22(OH)2可表示为:2CaSiO3·5MgSiO3·H2O |
| D.高岭石Al2(Si2O5)(OH)4可表示为:Al2O3·2SiO2·2H2O |
从人类健康或生活实际的角度考虑,下列叙述正确的是
| A.用铝锅炒菜比用铁锅好 |
| B.氯气泄漏后应顺风向低处跑 |
| C.用SO2漂白食品不影响人类健康 |
| D.食用“加碘”食盐有利于健康 |
下图装置可用于( )

| A.加热NaHCO3制CO2 |
| B.用Cu与稀HNO3反应制NO |
| C.用NH4Cl与浓NaOH溶液反应制NH3 |
| D.用KMnO4与浓HCl反应制Cl2 |
向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当滴入几滴溴水后,混合液中出现红色,那么由此得出下列结论错误的是( )
| A.该晶体中一定含有SCN- |
| B.Fe3+的氧化性比Br2的氧化性强 |
| C.Fe2+不能与SCN-形成血红色的化合物 |
| D.Fe2+被Br2氧化成Fe3+ |