实验室用乙醇和浓硫酸反应制备乙烯,化学方程式为:C2H5OH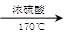 CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2 ,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2 ,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷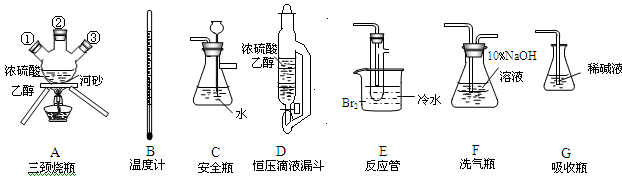
(1)如果气体流向从左到右,正确的连接顺序是:
B经A①插入A中,D接入②;A③接 接 接 接 接。
(2)温度计水银球的正确位置是 。
(3)装置D与分流漏斗相比,其主要优点是 。
(4)装置C的主要作用是 ,装置F的作用是 。
(5)在反应管E中进行的主要反应的化学方程式为 。
(6)装置E烧杯中的泠水和反应管内液溴上的水层作用均是 。若将装置F拆除,在E中的主要反应为 。
【化学一选修5;有机化学基础】(15分)A、B、C、D、,E、F、G、H八种有机物间转化关系如图所示。其中气体A在标准状况下密度为1.25 g/L,且碳元素的质量分数为85.7%:E普遍存在于食物中(如菠菜等);F分子中含有一个六元环,晶体H中仅含C、H、O三种元素,且原子个数比为1:3:3。
回答下列问题:
回答下列问题:
(1)C的结构简式为 ;晶体H的化学式为 。
(2)下列转化过程涉及的化学反应中,属于取代反应的是 (填序号)。
①A→B ②B→C ③C→D ④D→E ⑤C、E→F
(3)写出D与新制Cu(OH)2悬浊液反应的方程式:
写出C与E生成高分子化合物的化学方程式: 。
(4)简述确定有机物B中官能团种类的实验方法: ,观察生成沉淀颜色便可确定。
(5)有机物W与F的有相同的官能团(包括种类及数目),分子组成比F多四个碳原子.也含有一个六元环,其 谱图上只有一个峰,写出符合上述条件的W的结构简式 。
谱图上只有一个峰,写出符合上述条件的W的结构简式 。
(6)G的相对分子质量为44,则 反应过程中,理论上制备G的原子利用率为 。
反应过程中,理论上制备G的原子利用率为 。
实验室制备1,2二溴乙烷的反应原理如下:
CH3CH2OH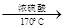 CH2===CH2 CH2===CH2+Br2―→BrCH2CH2Br
CH2===CH2 CH2===CH2+Br2―→BrCH2CH2Br
乙醇 1,2二溴乙烷 乙醚
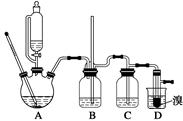
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如图所示,有关数据列表如下:
 状态 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g·cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
-130 |
9 |
-116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是_____;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是_____________________________;
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_______层(填“上”或“下”);
(5)若产物中有少量未反应的Br2,最好用________洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液
c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用__________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是______________________;
但又不能过度冷却(如用冰水),其原因是__________________________________________。
苹果酸广泛存在于水果肉中,是一种常用的食品添加剂。物理分析测得苹果酸的相对分子质量为134,存在5种不同环境的H原子,ω(C)=35.82%、ω(H)=4.48%、ω(O)=59.70%。取2.68g苹果酸溶于水配成溶液,用0.80mol/LNaOH溶液滴定耗去50.00mL恰好中和,1mol苹果酸与足量的Na反应生成1.5mol的H2。试求:
(1)苹果酸的分子式;
(2)苹果酸分子中含羧基的个数;
(3)请写出苹果酸的结构简式。
3-丁酮酸乙酯在有机合成中用途极广,广泛用于药物合成,还用作食品的着香剂。其相对分子质量为130,常温下为无色液体,沸点181℃,受热温度超过95℃摄氏度时就会分解;易溶于水,与乙醇、乙酸乙酯等有机试剂以任意比混溶;实验室可用以乙酸乙酯和金属钠为原料制备。乙酸乙酯相对分子质量为88,常温下为无色易挥发液体,微溶于水,沸点77℃。
【反应原理】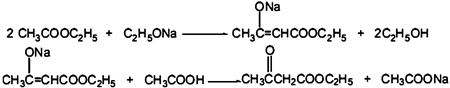
【实验装置】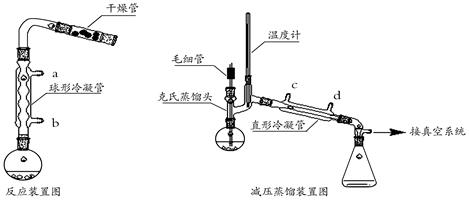
【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是 。
(2)反应装置中加干燥管是为了 。两个装置中冷凝管的作用 (填“相同”或“不相同”),冷却水进水口分别为 和 (填图中的字母)。
(3)产物后处理中,滴加稀醋酸的目的是 ,稀醋酸不能加多了,原因是 。用分液漏斗分离出酯层的操作叫 。碳酸钠溶液洗涤的目的是 。加碳酸钾的目的是 。
(4)采用减压蒸馏的原因是 。
(5)本实验所得到的3-丁酮酸乙酯产率是 (填正确答案标号)。
| A.10% | B.22% | C.19% | D.40% |
有机物A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 |
解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空:(1)A的相对分 子质量为: 。 |
| (2)将此9. 0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为: 。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团: 。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有 种氢原子。 |
| (5)综上所述,A的结构简式 。 |
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下,按下列合成步骤回答问题: (1)在加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了___________气体。继续滴加至液溴滴完。装置d的作用是 ,
(1)在加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了___________气体。继续滴加至液溴滴完。装置d的作用是 ,
写出a中有关反应化学方程式 。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0 mL水、8 mL l0%的NaOH溶液、10 mL水洗涤。其中NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为__________________,要进一步提纯,下列操作中必须的是____________(填入正确选项前的字母);
A、重结晶 B、过滤 C、蒸馏 D、萃取
(4)在该实验中,a的容积最适合的是______(填入正确选项前的字母)。
A、25 mL B、50 mL C、250 mL D、509 mL
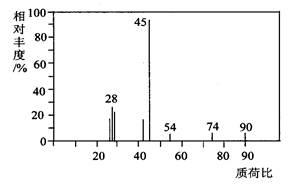
(5)在最新的家用汽车的调查中发现,新车中气体的质量不符合标准。汽车污染主要来源于汽车配件及材料.它们都会产生大量有毒的有机物气体.其中一种有毒气体的质谱图如图:
①则由图可知该分子的相对分子质量是________。
②若该分子的核磁共振氢谱中有4个吸收峰则有机物的名称为_______。
③其苯环上的一氯代物有________种。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤
称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. 试通过计算填空:
(1)A的相对分子质量为: .
(2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g,则A的分子式为: .
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况) 则A中官能团的结构简式: 、 .
(4)A的核磁共振氢谱如图:

则A中含有 种氢原子
(5)综上所述,A的结构简式 .A与浓H2SO4混合,在一定条件下反应生成六元环状物B,B的结构简式 .
有A、B两种烃,它们的组成相同,都约含85.7%的碳,烃A对氢气的相对密度是28;烃B式量比空气的平均式量稍小,且实验式与A相同,烃A、B都能使溴的四氯化碳溶液褪色,根据以上实验事实回答问题。
(1)推断A、B两烃的化学式。A ;B 。
(2)A、B中 (填A或B)共有四种同分异构体,同分异构体的名称是 。
(3)写出B与溴的四氯化碳溶液反应的化学方程式: 。
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为:
(2)A中的碳原子是否都处于同一平面 (填“是”或“不是”);
(3)在下图中,D1、D2互为同分异构体,E1 、E2互为同分异构体。

反应②的化学方程式为:____________________
C的化学名称为:_________________
E2的结构简式是:_________________
④、⑥的反应类型依次是:_____________,_______________
有机物A常用于食品行业。已知9.0 g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)A分子的质谱图如下图所示,从图中可知其相对分子质量是 ,则A的分子式是____________;
(2)A能与NaHCO3溶液发生反应,A一定含有的官能团是 ;
(3)A分子的核磁共振氢谱有4个吸收峰,峰面积之比是1:1:1:3,则A的结构简式是________________________;
(4)请写出官能团与A相同的同分异构体的结构简式 。
某有机物ag与0.8mol O2在密闭容器中充分混合后点燃。待充分反应后,将产物中的H2O(g)和其它气态产物先缓慢通过足量澄清石灰水,产生40g白色沉淀,溶液质量减少0.8g。余下气体通过浓硫酸干燥后,再缓慢通过足量灼热CuO,固体由黑变红。将产生的气体又缓慢通过足量过氧化钠,充分反应后固体质量增加11.2g且只有氧气放出(假设每一步都充分反应或吸收)。请回答下列问题:
①通过计算确定该有机物化学式为 。
②若ag该有机物恰好与18.4g金属钠完全反应,试确定该有机物的结构简式 。
③若0.4mol该有机物恰好与9.2g金属钠完全反应,试确定该有机物的结构简式 。
(已知① 醚不与钠反应 ②一个碳原子上同时连2个或多个羟基是不稳定的)
如下a、b、c、d、e、f是六种有机物,其中a是烃类,其余是烃的衍生物,下列有关说法不正确的是
| A.若a的相对分子质量是42,则d是丙醛 |
| B.若d的相对分子质量是44,则a是乙炔 |
| C.若a为苯乙烯(C6H5—CH=CH2),则f的分子式是C16H16O2 |
| D.若a为单烯烃,则d与f的最简式一定相同 |
乌尔曼反应是偶联反应的一种,可以实现卤代苯与含氮杂环的反应。例如:
(1)化合物(Ⅰ)的分子式为 ;
(2)化合物Ⅳ是化合物Ⅱ的同系物,分子式为C8H9Br,Ⅳ为苯的对位二取代物,其核磁共振氢谱图共有4组峰,峰面积比为2:2:2:3,其结构简式为 (任写一种)。
(3)1mol化合物Ⅲ可以与 mol H2发生加成反应,产物结构简式为 。
(4)化合物Ⅳ的一种同分异构体Ⅴ的结构简式为 ,Ⅴ与氢氧化钠溶液醇溶液加热条件下反应的化学方程式为 。
,Ⅴ与氢氧化钠溶液醇溶液加热条件下反应的化学方程式为 。
(5)一定条件下, 与
与 也可以发生类似反应①的反应,参加反应的分子数之比为2:1,则生成的产物的结构简式为 。
也可以发生类似反应①的反应,参加反应的分子数之比为2:1,则生成的产物的结构简式为 。
(4分)核磁共振谱是测定有机物分子结构最有用的工具之一。瑞士科学家维特里希等三人即是利用核磁共振技术测定生物大分子的三维结构而获得2002年诺贝尔化学奖。在有机物分子中,不同位置的氢原子在质子核磁共振谱(PMR)中给出的峰值(信号)也不同,根据峰(信号)可以确定有机物分子中氢原子的种类和数目。例如:乙醛的结构式为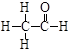 ,其PMR谱中有2个信号峰,其强度之比为3∶1。
,其PMR谱中有2个信号峰,其强度之比为3∶1。
(1)下列有机物分子中,在质子核磁共振谱中只给出一种峰(信号)的是________。
| A.CH3—CH3 | B.CH3CHO |
| C.CH3CH2OCH2CH3 | D.CH3COCH3 |
(2)化合物A和B的分子式都是C2H4Br2,A的PMR谱上只有1个峰,则A的结构简式为___________。B的PMR谱上有__________________个峰,强度比为________________。