铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为______ ____,Fe3O4可写成FeO·Fe2O3的形式,如果将Pb3O4也写成相对应的形式应为:______________
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___________________。PbO2可由PbO与次氯酸钠溶液反应制得,其反应的离子方程式为______________。

(3)PbO2在加热过程发生分解的失重曲线如右图所示,已知失重曲线上的a点为样品失重4.0%(即 ×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n_______________,____________。
×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n_______________,____________。
Ⅰ.CO可用于合成甲醇。在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
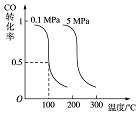
(1)该反应属于 反应(填“吸热”或“放热”)。
(2)100℃时,该反应的平衡常数:K= (用a、b 的代数式表示)。
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO,2a mol H2,达到平衡时CO转化率 (填“增大”“不变”或“减小”)
Ⅱ.T ℃时,纯水中c(OH-)为10-6 mol·L-1,则该温度时
(1)将pH=3 的H2SO4溶液与pH=10的NaOH溶液按体积比9:2 混合,所得混合溶液的pH为 。
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
Ⅲ. 在25mL的氢氧化钠溶液中逐滴加入0.2 mol/ L醋酸溶液,滴定曲线如图所示。

(1)该氢氧化钠溶液浓度为________________。
(2)在B点,a_________12.5 mL(填“<”“>”或“=”)。若由体积相等的氢氧化钠溶液和醋酸溶液混合且恰好呈中性,则混合前c(NaOH) c(CH3COOH)
(3)在D点,溶液中离子浓度大小关系为_____________________。
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
(1)F的基态原子电子排布式为 。
(2)B、C、D的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是 。
a.分子中都含有σ键和π键
b.B2A2分子的沸点明显低于A2D2分子
c.都是含极性键和非极性键的非极性分子
d.互为等电子体,分子的空间构型都为直线形
e.中心原子都是sp杂化
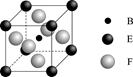
(4)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中。与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 。
(5)向GSO4(aq)中逐滴加入过量氨水,会发生先产生蓝色沉淀后沉淀消失,写出沉淀消失的离子反应方程式: 。
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)  2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如图所示。试回答下列问题:
2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如图所示。试回答下列问题:

(1)实验1中,4s时A的转化率为 ;此条件下该反应的平衡常数K1的值为 。
(2)实验2与实验1对比,其可能隐含的反应条件是 。
(3)根据实验3与实验1的图象比较,可推测该反应是 (填“放热”或“吸热”)反应。设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1 K2 K3(填“>”、“<”或“=”)。
(4)为了验证增大催化剂的表面积、增大压强可提高化学反应速率这一结论,某同学在实验1的基础上又利用该容器设计了实验4和实验5,部分实验条件及数据见下表。请将表格补充完整。
| 实验编号 及其目的 |
V(容积)/L |
t/℃ |
n(A起始)/mol |
n(B起始)/mol |
催化剂的质量/g |
催化剂的表面积/m2·g—1 |
| 实验1参照对比实验 |
2 |
80 |
1.2 |
0 |
a |
b |
| 实验4:催化剂的表面积对反应速率的影响 |
|
|
|
|
|
|
| 实验5目的: |
1 |
|
|
|
|
|
已知,有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平。A、B、C有如下关系:
则下列推断不正确的是
A.鉴别A和甲烷可选择使用酸性高锰酸钾溶液
B.乙酸中含有的官能团为羟基
C.C的名称为乙酸乙酯
D.过量饮用B会对人体造成伤害
X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1)L的元素符号为___________;M在元素周期表中的位置为__________________。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是_________________。该三种酸同温同浓度的前提下,电离平衡常数最小的是_____________(填化学式)
(3)Y的最高价氧化物的电子式为__________。原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是____________________________。
X与Y能形成多种化合物,其中一种含有10电子的化合物是______________,该化合物可与氧气在碱性溶液的条件下形成原电池供能,写出负极涉及的电极方程式____________________。
(4)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是_____________。
Ⅰ.硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有CO2,应选择的试剂有 。
| A.NaOH溶液 | B.酸性KMnO4溶液 | C.澄清石灰水 | D.盐酸 |
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。
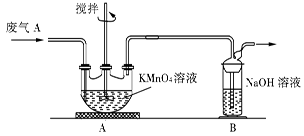
①为了保证实验成功,装置A应具有的现象是 ,搅拌的目的是 。
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是 。
Ⅱ.溴酸钾具有毒性,是一种常用的分析试剂和氧化剂,实验室中制备过程如下:
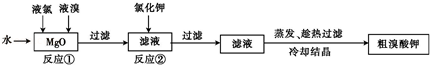
已知反应②是复分解反应,根据上述转化关系回答下列问题:
(1)反应①的化学方程式为 .
(2)反应②的化学方程式为 .
(3)现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加KBrO3的物质的量的关系如图所示.请回答下列问题:
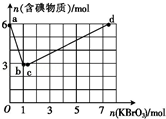
①已知b点时,KI反应完全,转移的电子数为 .
②b→c过程中,仅有一种元素的化合价发生了变化.则反应时氧化剂与还原剂的物质的量之比为 .
③d点时,n(KBrO3)为 .
某强酸性溶液X,可能含有Al3+、Ba2+、NH4+ 、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:

(1)由强酸性条件即可判断溶液X中一定不存在的离子有 。
(2)溶液X中,关于NO3-的判断一定正确的是_ ___。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 。
(4)转化⑥发生反应的现象为 。
(5)转化④中产生H的离子方程式为 。
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为____。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液
某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
(1)写出用惰性电极电解M溶液的离子方程式__________。写出F的电子式___________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是______________。
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图所示,“则A与B溶液”反应后溶液中的溶质化学式为________。
(4)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是______________.
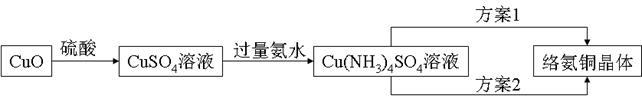
络氨铜【[Cu(NH3)4]SO4】是一种重要的染料及农药中间体。已知:①以氧化铜为主要原料合成该物质的合成路线如下图:
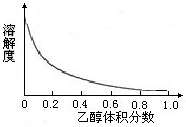
②络氨铜在乙醇-水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下。
③(NH4)2SO4在水中可溶,在乙醇中难溶。
请根据以上信息回答下列问题:
(1)由CuO制出的CuSO4溶液中常含有 Fe2(SO4)3杂质,请设计一个可行方案,检验CuSO4溶液中是否含有Fe3+: 。
(2)[Cu(NH3)4]SO4在水中存在如下解离过程:[Cu(NH3)4]SO4===[Cu(NH3)4]2+(深蓝色离子)+SO42-;[Cu(NH3)4]2+ Cu2++4NH3。请写出在CuSO4溶液中逐滴加入氨水至过量的反应现象: 。
Cu2++4NH3。请写出在CuSO4溶液中逐滴加入氨水至过量的反应现象: 。
(3)①方案1的实验步骤为:加热蒸发→冷却结晶→过滤洗涤→干燥。该方案存在明显缺陷,因为得到的产物晶体往往含有Cu2(OH)2SO4杂质,产生该杂质的原因是 。
②方案2是较为理想的结晶方案,先向溶液C加入适量 (填物质名称),再过滤、洗涤、干燥即可得到较纯净的晶体。下列选项中,最适合作为滤出晶体洗涤液的是 。
| A.乙醇 | B.蒸馏水 | C.乙醇和水的混合液 | D.饱和硫酸钠溶液 |
洗涤沉淀的操作方法是 。
(4)氨含量的测定:准确称取a g络氨铜样品,加入过量NaOH溶液微热,使NH3充分释放,并被准确量取的30.00mL 0.5000mol.L-1HCl溶液充分吸收。吸收液用0.1200mol·L-1的NaOH溶液滴定,消耗的NaOH溶液的体积为V L,则络氨铜样品中氨的质量分数为 (用含a、V的字母表达)。
工业生产硝酸铵的流程如下图所示

(1)硝酸铵的水溶液呈 (填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为: 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。

①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是
| A.及时分离出NH3可以提高H2的平衡转化率 |
| B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件 |
| C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N) |
| D.M点对应的H2转化率是75% |
E.如果N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K≈0.93
(3)尿素(H2NCONH2)是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为二步反应:第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下左图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第__________步反应决定,总反应进行到________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________mol·L-1·min-1。
③在右图中画出第二步反应的平衡常数K随温度的变化的示意图。
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:FeO·Cr2O3 + 24NaOH + 7KClO3 = 12Na2CrO4 + 3Fe2O3 + 7KCl + 12H2O。
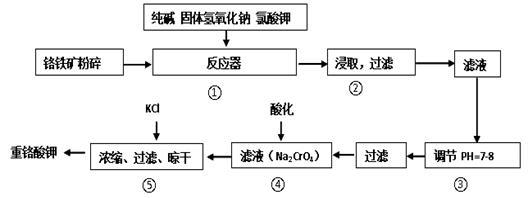
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出二氧化硅、氧化铝分别与碳酸钠反应的化学方程式:______________、________________。
(2)NaFeO2能强烈水解,在操作②中生成沉淀而除去,写出该反应的化学方程式: 。
简述检验溶液中是否存在Fe3 +的方法是: 。
(3)操作③的目的是什么,用简要的文字和化学方程式说明: 。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: 。
(5)铬(Cr)与铝的性质相似,试写出Cr(OH)3 溶于NaOH 溶液所发生反应的离子反应方程式: 。
下图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:


(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①Y电极上的电极反应式 。
②在X电极附近观察到的现象是 。
(2)若X、Y都是惰性电极,a是浓度均为2mol·L-1的AgNO3与Cu(NO3)2的混合溶液1L,电解一段时间后,X电极上有3.2g铜析出,写出电解过程中有关反应的离子方程式 ,此时直流电源已输出 mol电子。
(3)如果要用电解的方法精炼粗铜(含有Fe、Zn、Pt、C等杂质),电解质溶液a选用CuSO4溶液,则:
①X电极的材料是 ,电极反应式 。
②精炼完成后,硫酸铜溶液的浓度 (填“变大”、“变小”或“不变”)
(4)铅蓄电池反应的化学方程式是Pb+PbO2+2H2SO4=2PbSO4+2H2O。若以铅蓄电池为电源,用惰性电极电解CuSO4溶液,在电解过程中生成11.2LO2(标准状况),则铅蓄电池中消耗的硫酸的物质的量为 。
A和B两种有机物可以互溶,有关性质如下:
| |
相对密度(20℃) |
熔点 |
沸点 |
溶解性 |
| A |
0.7137 |
-116.6°C |
34.5°C |
不溶于水 |
| B |
0.7893 |
-117.3°C |
78.5°C |
与水以任意比混溶 |
(1)要除去A和B的混合物中的少量A,可采用_______________方法即可得到B。
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
(2)若B的分子式为C2H6O,核磁共振氢谱表明其分子中有三种化学环境不同的氯原子,强度之比为3︰2︰1。则B的结构简式为__________。
(3)若质谱图显示A的相对分子质量为74,红外光谱如图所示,则A的结构简式为_________________。

(4)准确称取一定质量的A和B的混合物,在足量氧气中充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增重14.4g和26.4g。计算混合物中A和B的物质的量之比______________。
某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
| 阳离子 |
K+ |
Cu2+ |
Fe3+ |
Al3+ |
Fe2+ |
| 阴离子 |
Cl- |
CO32- |
NO |
SO42- |
SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是____________(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是 。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式__________。
(4)甲同学最终确定原溶液中所含阳离子是________,阴离子是________(写离子符号)。
(5)另取100 mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为________g。