常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、[Al(OH)4]-、Cl- |
| C.pH=12的溶液:K+、Na+、CH3COO-、Br- |
| D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
胃酸过多是常见的胃病,下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末;(2)能溶于水,水溶液呈弱碱性;(3)受热分解;④遇酸及酸性药物则产生二氧化碳;(5)胃酸过多患者服用后多见胃胀气,甚至有引起胃溃疡穿孔的危险;(6)焰色反应为黄色。
乙:(1)与胃酸的中和作用缓慢持久,可维持3~4小时;②凝胶本身覆盖于溃疡面上,具有保护作用,并能吸附H+;(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成分是______________(填化学式,下同);乙中含有的主要化学成分是______________。
(2)试写出甲中含有的主要化学成分引起胃胀气的离子方程式 ___
(3)试写出乙溶于NaOH溶液的离子方程式 。
下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中,K+、Fe2+、I-、Br-可以大量共存 |
| B.和KI溶液反应的离子方程式: Fe3++2I-=Fe2++I2 |
| C.1L0.1mol/L该溶液和足量的Cu充分反应,离子方程式为Cu+2Fe3+=Cu2++2Fe2+ |
| D.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ |
两个体积相同的容器,一个盛有二氧化硫,一个盛有杂质为水蒸气的二氧化碳,在同温(120℃以上)同压(小于1个标准大气压)下,两容器内的气体一定相同的是
| A.质子质量 | B.质量 | C.密度 | D.原子总数 |
有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是
①Fe+Cu2+=Fe2++Cu
②Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
③Cl2+H2O = H++Cl-+HClO
④CO32-+2H+=CO2↑+H2O
⑤Ag++Cl-=AgCl↓
| A.只有③ | B.②③ | C.③⑤ | D.①④ |
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
| A.向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明Cl2的氧化性强于I2 |
| B.新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,说明Cl2有漂白性 |
| C.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| D.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤NaHSO4 ⑥AlCl3 ⑦NaAlO2
| A.①⑤ | B.②③④⑥⑦ | C.①②③④ | D.全部 |
下列反应中,能证明SiO2是酸性氧化物的是
①SiO2+4HF=SiF4↑+2H2O ②SiO2+CaO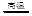 CaSiO3
CaSiO3
③SiO2+2NaOH=Na2SiO3+H2O ④SiO2+2C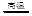 Si+2CO↑
Si+2CO↑
| A.①② | B.②③ | C.③④ | D.①④ |
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体,现将此无色混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色,对于原混合气体成分的判断中正确的是
| A.肯定有NO和NO2 | B.肯定有SO2和NO |
| C.可能有Cl2和O2 | D.肯定没有Cl2、NO2,可能有O2 |
下列叙述中正确的是
①Na2O和Na2O2都能和水反应生成碱,它们都是碱性氧化物②Na2CO3和NaHCO3溶液都与CaCl2溶液反应得到白色沉淀③钠在常温下不容易被氧化④Na2O2可作供氧剂,而Na2O不行⑤除去Na2CO3固体中混有的NaHCO3,将混合物加热至质量不再发生变化⑥可用玻璃棒蘸取少量待测物质的浓溶液做焰色反应实验
| A.②③④⑤ | B.④⑤ | C.②④⑥ | D.①②⑥ |
下列说法不正确的是
| A.温度相同、体积相同的O2(g)和N2(g)分子数相同 |
| B.等温等压下,SO2气体与CO2气体的密度之比等于16:11 |
| C.温度和容积相同的两气罐中分别盛有5molO2(g)和2molN2(g),两容积中的压强之比等于5:2 |
| D.等温等压条件下,5molO2(g)和2molH2(g)的体积之比等于5:2 |
为了除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是
①饱和的Na2CO3溶液②饱和的NaHCO3溶液③浓硫酸④灼热的铜网⑤碱石灰
| A.①③④ | B.②③④ | C.②④⑤ | D.③④⑤ |
若NA代表阿伏伽德罗常数的值,下列说法正确的是
| A.等物质的量的N2与O2中的所含分子数均为NA |
| B.标准状况下,5.6LCCl4含有的分子数为0.25NA |
| C.常温常压下,22CO2含有的原子数为1.5NA |
| D.1mol/LNaOH溶液中含有的Na+的数目为NA |
下列指定条件下的溶液中离子能够大量共存的是
| A.强酸性溶液中:Na+、CO32-、NH4+ 、NO3- |
| B.无色溶液中:Cl-、H+、Cu2+、SO42- |
| C.使石蕊试液变蓝的溶液中:CO32-、Na+、MnO4-、K+ |
| D.含SCN-的溶液中:K+、NH4+ 、Cl-、Fe3+ |
已知反应:①MnO2+4HCl PbCl2+Cl2↑+2H2O, ②Cu+2Fe3+=Cu2++2Fe2+, ③Cl2+2Fe2+=2Cl-+2Fe3+。则有关物质(离子)的氧化性由强到弱的顺序为
PbCl2+Cl2↑+2H2O, ②Cu+2Fe3+=Cu2++2Fe2+, ③Cl2+2Fe2+=2Cl-+2Fe3+。则有关物质(离子)的氧化性由强到弱的顺序为
| A.Cl2>Fe3+>Cu2+>MnO2 | B.MnO2>Cl2>Fe3+>Cu2+ |
| C.Fe3+>Cu2+>MnO2>Cl2 | D.Cu2+>Fe3+>Cl2>MnO2 |