苯乙烯是重要的化工原料。下列有关苯乙烯的说法错误的是( )
| A. |
与液溴混合后加入铁粉可发生取代反应 |
B. |
能使酸性高锰酸钾溶液褪色 |
| C. |
与氯化氢反应可以生成氯代苯乙烯 |
D. |
在催化剂存在下可以制得聚苯乙烯 |
下列叙述正确的是( )
| A. |
24g镁与27g铝中,含有相同的质子数 |
B. |
同等质量的氧气和臭氧中,电子数相同 |
| C. |
1mol重水与1mol水中,中子数比为2∶1 |
D. |
1mol乙烷和1 mol乙烯中,化学键数相同 |
化学与生活密切相关。下列说法错误的是( )
| A. |
泡沫灭火器可用于一般的起火,也适用于电器起火 |
B. |
疫苗一般应冷藏存放,以避免蛋白质变性 |
| C. |
家庭装修时用水性漆替代传统的油性漆,有利于健康及环境 |
D. |
电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 |
硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态S原子电子占据最高能级的电子云轮廓图为________ 形。
(2)根据价层电子对互斥理论, , , 的气态分子中,中心原子价层电子对数不同于其他分子的是________。
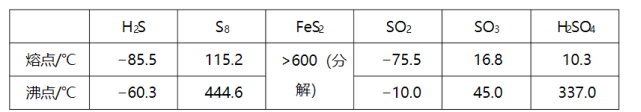
(3)图(a)为 的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________。
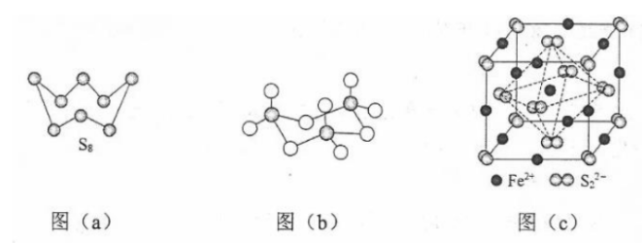
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三氯分子。该分子中S原子的杂化轨道类型为________。
(5) 晶体的晶胞如图(c)所示,晶胞边长为 , 相对式量为M、阿伏伽德罗常数的值为 , 其晶体密度的计算表达式为________ ;晶胞中 位于 所形成的正八面体的体心,该正八面体的边长为________ nm
(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图,回答下列问题:
(1)晒制蓝图时,用 作感光剂,以 溶液为显色剂.其光解反应的化学方程式为 ,显色反应的化学方程式为________.
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下面所示装置进行实验。
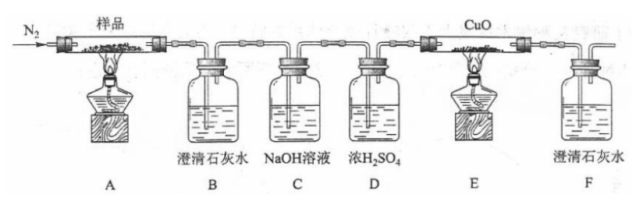
①通入氮气的目的是________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有________、________。
③为防止倒吸,停止实验时应进行的操作是________。
④样品完全分解后,装置A中的残留物含有 和 ,检验 存在的方法是:________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量 样品于锥形瓶中,溶解后加稀 酸化,用 溶液滴定至终点。滴定终点的现象是________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用 溶液滴定至终点,消耗 溶液 ,该晶体中铁的质量分数的表达式为________。
催化重整不仅可以得到合成气(CO和
)。还对温室气体的减排具有重要意义。回答下列问题:
(1) 催化重整反应为: 。
已知:
该催化重整反应的 ________ 。有利于提高 平衡转化率的条件是________(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2L的容器中加入 以及催化剂进行重整反应。达到平衡时 的转化率是50%,其平衡常数为________ 。
(2)反中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
| |
积碳反应
|
消碳反应
|
|
|
|
75 |
172 |
|
| 活化能/ |
催化剂X |
33 |
91 |
| 催化剂Y |
43 |
72 |
|
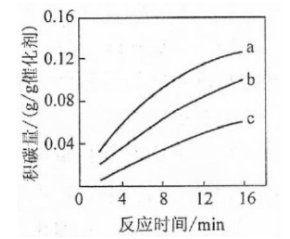
①由上表判断,催化剂X________Y(填"优于或劣于"),理由是________.在反应进料气组成,压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如右图所示,升高温度时,下列关于积碳反应,消碳反应的平衡常数(K)和速率(v)的叙述正确的是________(填标号)
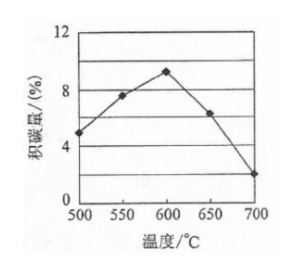
| A. | 、 均增加 |
| B. | 减小、 增加 |
| C. | 减小、 增加 |
| D. | 增加的倍数比 增加的倍数大 |
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为 (k为速率常数)。在 一定时,不同 下积碳量随时间的变化趋势如右图所示,则 、 、 从大到小的顺序为________
我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有  和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子  形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:

回答下列问题:
(1)焙烧过程中主要反应的化学方程式为________。
(2)滤渣1的主要成分出 外还有________;氧化除杂工序中ZnO的作用是________.若不通入氧气,其后果是________。
(3)溶液中的 可用锌粉除去,还原除杂工序中反应的离子方程式为________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为________;沉积锌后的电解液可返回________工序继续使用。
下列实验过程可以达到实验目的的是( )
| 编号 |
实验目的 |
实验过程 |
| A |
配制 的溶液 |
称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容 |
| B |
探究维生素C的还原性 |
向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
| C |
制取并纯化氢气 |
向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和 溶液 |
| D |
探究浓度对反应速率的影响 |
向2支盛有5mL不同浓度 溶液的试管中同时加入2mL5% 溶液,观察实验现象 |
| A. | A |
B. | B |
C. | C |
D. | D |
我国科学家研发了一种室温下"可呼吸"的
二次电池,将
溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:
 ,下列说法错误的是()
,下列说法错误的是()
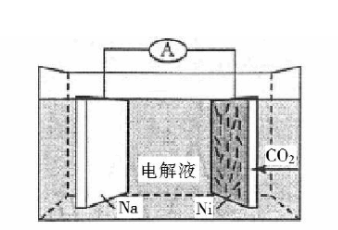
| A. | 放电时, 向负极移动 |
B. | 充电时释放 ,放电时吸收 |
| C. | 放电时,正极反应为: |
D. | 充电时,正极反应为 |
代表阿伏伽德罗常数的值,下列说法正确的是()
| A. | 常温常压下, 中所含P-P键数目为 |
B. | 溶液中所含 的数目为 |
| C. | 标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为 |
D. | 密闭容器中, 和 催化反应后分子总数为 |
W、X、Y和Z为原子序数一次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同,下列叙述正确的是()
| A. |
X与其他三种元素均可形成两种或两种以上的二元化合物 |
B. |
Y与其他三种元素分别形成的化合物中只含有离子键 |
| C. |
四种元素的简单离子具有相同的电子层结构 |
D. |
W的氧化物对应的水化物均为强酸 |
实验室用如图所示的装置进行甲烷与氯气在光照下反应的实验。
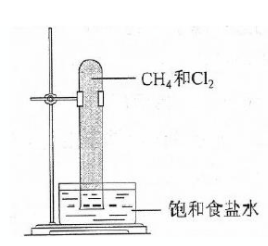
光照下反应一段时间后,下列装置示意图中能正确反应实验现象的是()
| A. |
|
B. |
|
C. |
|
D. |
|
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是()

| A. | 雾和霾的分散剂相同 |
B. | 雾霾中含有硝酸铵和硫酸铵 |
| C. | 是形成无机颗粒物的催化剂 |
D. | 雾霾的形成与过度施用氮肥有关 |
化学与生活密切相关,下列说法错误的是()
| A. |
碳酸钠可用于去除餐具的油污 |
B. |
漂白粉可用于生活用水的消毒 |
| C. |
氢氧化铝可用于中和过多的胃酸 |
D. |
碳酸钡可用于胃肠X射线造影检查 |
Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻,能量密度大等优良性能,得到广泛应用,回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________。(填标号)
| A. | |
| B. | |
| C. | |
| D. | |
(2) 与 具有相同的电子构型, 小于 ,原因是________。
(3) 是有机合成中常用的还原剂, 中的阴离子空间构型是________。中心原子的杂化形式为________, 中,存在________(填标号)。
| A. | 离子键 |
| B. | σ键 |
| C. | π键 |
| D. | 氢键 |
(4) 是离子晶体,其晶格能可通过图(a)的 Born-Haber循环计算得到

可知,Li原子的第一电离能为________ , O=O键键能为________ , 晶格能为________
(5) 具有反莹石结构,晶胞如图(b)所示。已知晶胞参数为0.4665mm,阿伏加德罗常数的值为 ,则 的密度为 ________ (列出计算式)。