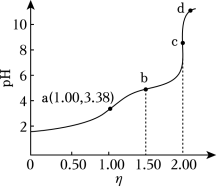
常温下,用浓度为 的 标准溶液滴定浓度均为 的 和 的混合溶液,滴定过程中溶液的 随 ( )的变化曲线如图所示。下列说法错误的是( )
| A. |
约为 |
| B. |
点 : |
| C. |
点 : |
| D. |
水的电离程度: |
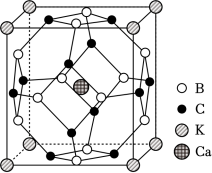
科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为 。阿伏加德罗常数的值为 。下列说法错误的是( )
| A. |
晶体最简化学式为 |
| B. |
晶体中与 最近且距离相等的 有 个 |
| C. |
晶胞中 和 原子构成的多面体有 个面 |
| D. |
晶体的密度为 |
油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄( )褪色的主要原因是发生了以下两种化学反应:
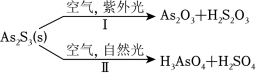
下列说法正确的是( )
| A. |
|
| B. |
反应Ⅰ和Ⅱ中,元素 和 都被氧化 |
| C. |
反应Ⅰ和Ⅱ中,参加反应的 Ⅰ<Ⅱ |
| D. |
反应Ⅰ和Ⅱ中,氧化 转移的电子数之比为 |
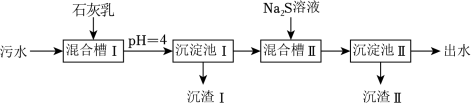
处理某铜冶金污水(含 )的部分流程如图:
已知:①溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
|
物质 |
|
|
|
|
|
开始沉淀 |
|
|
|
|
|
完全沉淀 |
|
|
|
|
② 。
下列说法错误的是( )
| A. |
“沉渣Ⅰ”中含有 和 |
| B. |
溶液呈碱性,其主要原因是 |
| C. |
“沉淀池Ⅱ”中,当 和 完全沉淀时,溶液中 |
| D. |
“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水 |
葡萄糖酸钙是一种重要的补钙剂,工业上以葡萄糖、碳酸钙为原料,在溴化钠溶液中采用间接电氧化反应制备葡萄糖酸钙,其阳极区反应过程如图:
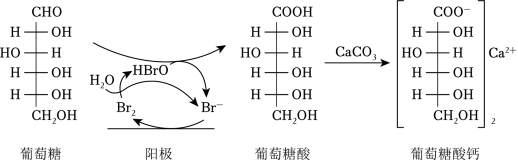
下列说法错误的是( )
| A. |
溴化钠起催化和导电作用 |
| B. |
每生成 葡萄糖酸钙,理论上电路中转移了 电子 |
| C. |
葡萄糖酸能通过分子内反应生成含有六元环状结构的产物 |
| D. |
葡萄糖能发生氧化、还原、取代、加成和消去反应 |
取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为 ),反应现象没有明显差别的是( )
|
选项 |
试剂① |
试剂② |
|
A |
氨水 |
溶液 |
|
B |
溶液 |
溶液 |
|
C |
溶液 |
酸性 溶液 |
|
D |
溶液 |
溶液 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
日光灯中用到的某种荧光粉的主要成分为 。已知: 和 为原子序数依次增大的前 号元素, 为金属元素。基态 原子 轨道上的电子数和 轨道上的电子数相等,基态 原子的未成对电子数之比为 。下列说法正确的是( )
| A. |
电负性: |
| B. |
原子半径: |
| C. |
和 的单质都能与水反应生成气体 |
| D. |
元素最高价氧化物对应的水化物具有强氧化性 |
下列有关电极方程式或离子方程式错误的是( )
| A. |
碱性锌锰电池的正极反应: |
| B. |
铅酸蓄电池充电时的阳极反应: |
| C. |
溶液滴入 溶液中: |
| D. |
加入水中: |
下列有关物质结构和性质的说法错误的是( )
| A. |
含有手性碳原子的分子叫做手性分子 |
| B. |
邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点 |
| C. |
酰胺在酸或碱存在并加热的条件下可发生水解反应 |
| D. |
冠醚( 冠 )的空穴与 尺寸适配,两者能通过弱相互作用形成超分子 |
下列玻璃仪器在相应实验中选用不合理的是( )

| A. |
重结晶法提纯苯甲酸:①②③ |
| B. |
蒸馏法分离 和 :③⑤⑥ |
| C. |
浓硫酸催化乙醇制备乙烯:③⑤ |
| D. |
酸碱滴定法测定 溶液浓度:④⑥ |
下列化学用语表述错误的是( )
| A. |
的电子式: |
| B. |
中子数为
的氧原子: |
| C. |
分子的
模型: |
| D. |
基态
原子的价层电子排布图: |
中华文化源远流长,化学与文化传承密不可分。下列说法错误的是( )
| A. |
青铜器“四羊方尊”的主要材质为合金 |
| B. |
长沙走马楼出土的竹木简牍主要成分是纤维素 |
| C. |
蔡伦采用碱液蒸煮制浆法造纸,该过程不涉及化学变化 |
| D. |
铜官窑彩瓷是以黏土为主要原料,经高温烧结而成 |
2﹣噻吩乙醇( )是抗血栓药物氯吡格雷的重要中间体,其制备方法如图:

Ⅰ.制钠砂。向烧瓶中加入 液体A和 金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至 ,加入 噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至 ,加入稍过量的环氧乙烷的四氢呋喃溶液,反应 。
Ⅳ.水解。恢复室温,加入 水,搅拌 ;加盐酸调 至 ,继续反应 ,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水 ,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品 。
回答下列问题:
(1)步骤Ⅰ中液体A可以选择__________。
| A. |
乙醇 |
| B. |
水 |
| C. |
甲苯 |
| D. |
液氨 |
(2)噻吩沸点低于吡咯(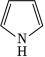 )的原因是__________。
)的原因是__________。
(3)步骤Ⅱ的化学方程式为__________。
(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是__________。
(5)步骤Ⅳ中用盐酸调节 的目的是__________。
(6)下列仪器在步骤Ⅴ中无需使用的是__________(填名称);无水 的作用为__________。

(7)产品的产率为__________(用 计算,精确至 )
某工厂采用如图工艺处理镍钴矿硫酸浸取液(含 和 )。实现镍、钴、镁元素的回收。
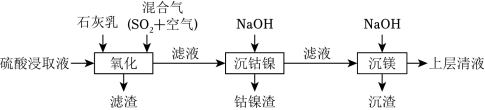
已知:
|
物质 |
Fe(OH)3 |
Co(OH)2 |
Ni(OH)2 |
Mg(OH)2 |
|
Ksp |
10﹣37.4 |
10﹣14.7 |
10﹣14.7 |
10﹣10.8 |
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为 __________(答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ), 中过氧键的数目为__________。
(3)“氧化”中,用石灰乳调节 , 被 氧化为 ,该反应的离子方程式为__________( 的电离第一步完全,第二步微弱);滤渣的成分为 、__________(填化学式)。
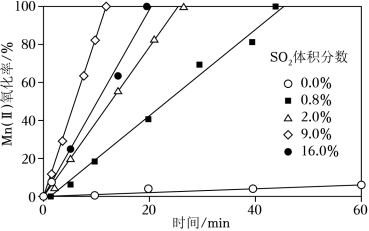
(4)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如图。 体积分数为__________时, (Ⅱ)氧化速率最大;继续增大 体积分数时, (Ⅱ)氧化速率减小的原因是__________。
(5)“沉钴镍”中得到的 (Ⅱ)在空气中可被氧化成 ,该反应的化学方程式为__________。
(6)“沉镁”中为使 沉淀完全( ),需控制 不低于__________(精确至 )。