下列常用干燥剂,不能干燥氯气的是()。
| A.浓硫酸 | B.五氧二磷 | C.碱石灰 | D.氯化钙 |
制取较纯的Cl2,最好选用()。
| A.向上排空气法 | B.向下排空气法 |
| C.排水法 | D.排饱和食盐水法 |
反应A+3B 2C+2D在四种不同情况下的反应速率分别为:
2C+2D在四种不同情况下的反应速率分别为:
①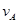 =0.15mol/(L·min)②
=0.15mol/(L·min)② =0.01mol/(L·s)
=0.01mol/(L·s)
③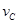 =0.40mol/(L·min) ④
=0.40mol/(L·min) ④ =0.45mol/(L·min),
=0.45mol/(L·min),
该反应进行的快慢顺序为(填序号)。
反应A+3B 2C+2D在四种不同情况下的反应速率分别为:
2C+2D在四种不同情况下的反应速率分别为:
① =0.15mol/(L·min)②
=0.15mol/(L·min)② =0.01mol/(L·s)
=0.01mol/(L·s)
③ =0.40mol/(L·min) ④
=0.40mol/(L·min) ④ =0.45mol/(L·min),
=0.45mol/(L·min),
该反应进行的快慢顺序为(填序号)。
对某一可逆反应来说,使用催化剂的作用是( )
| A.提高反应物的平衡转化率 |
| B.以同等程度改变正逆反应的速率 |
| C.增大正反应速率,减小逆反应速率 |
| D.改变平衡混合物的组成 |
盐酸与碳酸钙反应时,下列措施能使最初的反应速率明显加快的是()
| A.增加碳酸钙的量 | B.盐酸的用量增加一倍 |
| C.盐酸的用量减半、浓度加倍 | D.温度升高 |
将4molA气体和2molB气体在2L的容器中混合,并在一定条件下发生如下反应2A(g)+B(g)  2C(g),若2s后测得C的浓度为0.6mol/L,现有下列几种说法,其中正确的是( )
2C(g),若2s后测得C的浓度为0.6mol/L,现有下列几种说法,其中正确的是( )
①用物质A表示的平均反应速率为0.3mol/(L·s)
②用物质B表示的平均反应速率为0.6mol/(L·s)
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol/L
| A.①③ | B.①④ | C.②③ | D.③④ |
3A(g)  3B(?)+C(?)(正反应为吸热反应).随着温度的升高,气体的平均相对分子质量有变小趋势,则下列判断正确的是( )
3B(?)+C(?)(正反应为吸热反应).随着温度的升高,气体的平均相对分子质量有变小趋势,则下列判断正确的是( )
| A.B和c可能都是固体 | B.B和C一定都是气体 |
| C.若C为固体,则B一定是气体 | D.B和c可能都是气体 |
可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是 ( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是 ( )
| A.3v正(N2)= v正(H2) | B.v正(N2)= v逆(NH3) |
| C.2v正(H2)= 3v逆(NH3) | D.v正(N2)= 3v逆(H2) |
在一定条件下,A2(g)+B2(g) 2AB(g)达到平衡的标志是 ( )
2AB(g)达到平衡的标志是 ( )
| A.单位时间生成nmolA2的同时生成nmolAB |
| B.容器内的总压强不随时间变化 |
| C.单位时间生成2nmolAB的同时生成nmolB2 |
| D.单位时间内生成nmolA2的同时生成nmolB2 |
把100mL6mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的 ( )
| A.Na2CO3固体 | B.NaOH固体 | C.硫酸钾溶液 | D.水 |
一定条件下,可逆反应2A B+3C,在下列四种状态中处于平衡状态的是( )
B+3C,在下列四种状态中处于平衡状态的是( )
| 正反应速率 |
逆反应速率 |
| A.v(A)=2mol/(L·min), |
v(B)=2mol/(L·min) |
| B. v(A)=2mol/(L·min), |
v(C)=2mol/(L·min) |
| C. v(A)=1mol/(L·min), |
v(B)=2mol/(L·min) |
| D. v(A)=1mol/(L·min), |
v(C)=1.5mol/(L·min) |
已知氢化锂(LiH)属于离子化合物,氢化锂跟水反应可以放出H2,下列叙述中正确的是
| A.LiH的水溶液显中性 |
| B.LiH是一种强氧化剂 |
| C.LiH中的氢离子可以被还原成H2 |
| D.LiH中的氢离子与锂离子的核外电子排布相同 |
下列物质中,含有共价键的化合物是
| A.碘化氢 | B.烧碱 | C.液溴 | D.食盐 |