反应A+3B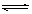 2C+2D在四种不同情况下的反应速率分别为:
2C+2D在四种不同情况下的反应速率分别为:
①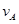 =0.15mol/(L·min) ②
=0.15mol/(L·min) ②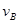 =0.01mol/(L·s)
=0.01mol/(L·s)
③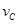 =0.40mol/(L·min) ④
=0.40mol/(L·min) ④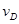 =0.45mol/(L·min),
=0.45mol/(L·min),
该反应进行的快慢顺序为(填序号) 。
反应A+3B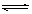 2C+2D在四种不同情况下的反应速率分别为:
2C+2D在四种不同情况下的反应速率分别为:
①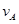 =0.15mol/(L·min) ②
=0.15mol/(L·min) ②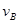 =0.01mol/(L·s)
=0.01mol/(L·s)
③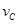 =0.40mol/(L·min) ④
=0.40mol/(L·min) ④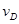 =0.45mol/(L·min),
=0.45mol/(L·min),
该反应进行的快慢顺序为(填序号) 。