某同学按图所示的装置进行电解实验。下列说法错误的是( )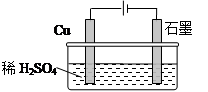
| A.电解初期,石墨电极上有H2产生 |
| B.整个电解过程中,H+的浓度不断增大 |
| C.电解一定时间后,石墨电极上有铜析出 |
D.电解初期,总反应方程式为:Cu+H2SO4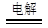 CuSO4+H2↑ CuSO4+H2↑ |
短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素。原子半径X<Y< W< R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之和相等。下列说法不正确的是( )
| A.Y、Z、R的简单离子具有相同的电子层结构 |
| B.X2Y分子间存在氢键,故X2Y比X2W稳定 |
| C.X、Z分别与Y均可形成A2B与A2B2型化合物,且A2B2均有较强的氧化性 |
| D.由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生反应 |
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4===Na2SO4+SO2+S↓+H2O,
下列各组实验中最先出现浑浊的是( )
| 实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
| V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
| A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
| B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
| C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
| D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
下列说法中不正确的是( )
| A.若XY3分子中X原子处于正三角形的中心,则XY3分子为非极性分子 |
| B.C2H5OH与C2H5Br相比,前者的沸点远高于后者,其原因是前者的分子间存在氢键 |
| C.同周期ⅠA族元素和 ⅦA族元素之间只能形成离子化合物 |
| D.由两种非金属元素组成的化合物分子中只可能有极性键,不会有非极性键 |
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
| A.弱酸溶液和强碱溶液反应 | B.生成了一种强酸弱碱盐 |
| C.强酸溶液和弱碱溶液反应 | D.一元强酸溶液和一元强碱溶液反应 |
若室温时,将pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度为( )
| A.10a+b-12 % | B.10a+b-14 % | C.1012-a-b % | D.1014-a-b % |
下列说法中,正确的一组是( )
①1H、2H、3H是氢元素的三种核素,互称为同位素
②饮用水可以用明矾、漂白粉来净化,两者的作用原理相同
③化合反应不一定是氧化还原反应
④有些吸热反应,不需要加热也能进行
⑤NH4Cl、 MgCl2均为离子化合物,均含有离子键和共价键
⑥除去水垢中的CaSO4,可以先用饱和的碳酸钠溶液浸泡,再加酸处理
| A.①④⑤ | B.②⑤⑥ | C.①②③④ | D.①③④⑥ |
下列说法正确的是( )
A.已知:H2(g)+ O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1 O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1 |
| B.已知:S(g)+O2(g)===SO2(g) ΔH1=-Q1 ;S(s)+O2(g)===SO2(g) ΔH2=-Q2,则Q1<Q2 |
C.已知: H2SO4(浓)+NaOH(aq)="==" H2SO4(浓)+NaOH(aq)="=="  Na2SO4(aq)+H2O(l) ΔH1; Na2SO4(aq)+H2O(l) ΔH1;CH3COOH(aq)+NH3·H2O(aq)===CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2| |
| D.已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g)ΔH=+489.0 kJ·mol-1 |
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
C(石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
则4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1641.0 kJ·mol-1
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq), 某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
I3-(aq), 某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( ) 
A.反应 I2(aq)+I-(aq) I3-(aq)的 △H>0 I3-(aq)的 △H>0 |
| B.若温度为T1、T2时,反应平衡常数分别为K1、K2,则K2>K1 |
| C.若反应进行到状态D时,一定有v正>v逆 |
| D.状态A与状态B相比,状态A的c(I2)大 |
下列实验操作中一定会造成实验值偏小的是( )
| A.将pH试纸用蒸馏水湿润后测某溶液的pH |
| B.配制500mL 0.10mol/L NaCl溶液,定容时俯视 |
| C.以标准盐酸溶液滴定未知浓度的NaOH溶液时,酸式滴定管未用标准溶液润洗 |
| D.用标准NaOH溶液滴定未知浓度的盐酸溶液,开始时滴定管尖嘴处没有气泡,结束时有气泡 |
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为( )
| A.22.1 g | B.27.2 g | C.30 g | D.无法计算 |
两种有机物以一定比例混合,一定条件下在a LO2(足量)中充分燃烧恢复到原状态,再通过足量的过氧化钠,得到气体仍是 a L,下列组合中符合此条件的是( )
| A.CH4、C2H4 | B.CH3CH2OH 、CH3COOH |
| C.C2H6、HCHO | D.HCOOH、CH3COOCH3 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.pH=1的溶液中: Fe2+、NO3-、SO42-、Na+ |
| B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| C.c(H+)/c(OH-)=1012的溶液中: NH4+、Al3+、NO3-、Cl- |
| D.c(Fe3+)="0.1" mol·L-1的溶液中: K+、ClO-、SO42-、SCN- |
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A.在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为NA |
| B.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
| C.1.0L的0.1 mol·L-1Na2S溶液中含有的S2-离子数为0.1NA |
| D.标准状况下,22.4L的CHCl3中含有的分子数为NA |