美国圣路易斯大学研制了一种新型的乙醇电池,其反应为:C2H5OH+3O2→ 2CO2+3H2O,电池示意如右图,下列说法正确的是
| A.a极为电池的正极 |
| B.b极发生氧化反应 |
| C.负极的反应为:4H++O2+4e-===2H2O |
| D.电池工作时,1mol乙醇被氧化时有12mol转移 |
乙醇、乙二醇、丙三醇分别与足量金属钠反应产生等体积的H2(相同状况下),则上述三种醇物质的量之比为
| A.2:3:6 | B.3:2:1 | C.4:3:1 | D.6:3:2 |
定量乙醇在氧气不足时燃烧,得到CO、CO2和水的总质量为27.6 g,若其中水的质量为10.8 g,则CO的质量是
| A.4.4 g | B.2.2 g | C.1.4 g | D.在2.2 g和4.4 g之间 |
用浓硫酸与分子式为C2H6O和C3H8O的醇的混合液在一定条件下进行脱水反应,可能生成的有机物的种数为 ( )
| A.5种 | B.6种 | C.8种 | D.9种 |
甲醇、乙二醇、丙三醇中分别与足量的金属钠反应,产生等体积的氢气(相同条件),则上述三种醇的物质的量之比是 ( )
| A.2∶3∶6 | B.6∶3∶2 | C.4∶3∶1 | D.3∶2∶1 |
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)△H;右图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
CH3OH(g)△H;右图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
0(填“>、<或= ”)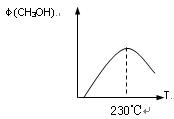
(2)若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K 1 (填“>、<或= ”)
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
(4)利用甲醇燃料电池设计如右图所示的装置:则该装置中Cu极为 极。
①写出b极的电极反应式 。
②当铜片的质量变化为12.8 g时:a极上消耗的O2在标准状况下的体积为 L。
一定条件下,由A、B两种有机物组成的气态混合物,无论A、B的含量如何变化,完全燃烧10 mL这种混合物,消耗O2的量都不改变,这两种有机物肯定是( )
A.C2H4O、C2H6 B.C2H4O、C2H4 C.C2H6O、C2H4 D.C2H6O、C2H6
某有机样品3.1 g完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重7.1 g,经过滤得到10 g沉淀。该有机样品是( )
| A.乙二醇 | B.乙醇 | C.乙醛 | D.丙三醇 |
某煤化厂设计了如下清洁生产工艺,先用两种方法同时生产原料气,再调整①②的比例,合成塔中催化剂为CuO/ZnO/Al2O3/V2O3)。该催化剂在250℃和5MPa的操作条件下表现出很好的活性。合成气经循环利用,最终碳元素全部转变甲醇,排空的只有水蒸气,合成原理简图为:
试回答下列问题
(1)工业上用的催化剂由CuO和ZnO组成(质量比为1∶1),最终体系中含二氧化碳, Cu2O的比例也保持相对恒定,从平衡角度考虑,该反应的化学方程式为:
▲ 。
(2)参考CO+2H2 CH3OH的平衡常数,工业上采用稍高的压强(5MPa)和250℃,其可能原因是: ▲ 。
CH3OH的平衡常数,工业上采用稍高的压强(5MPa)和250℃,其可能原因是: ▲ 。
(3)为使①和②中CO、CO2及H2合成甲醇时原子利用率最高,且各物质均无剩余(假定转化率为100%)。反应①产生的气体与反应②产生的气体最佳体积比为 ▲ 。
(4)某合作学习小组的同学按照上题(3)的结论,取①的产物与②的产物混合气体67.2L(标准状况),其中CO的体积分数为x ,通过模拟装置合成,得到甲醇的物质的量随CO体积分数变化的函数关系式,并作出图象 (假定CO先与H2反应,CO完全反应后,CO2才与H2反应,且各步转化率均为100%)。
某有机样品3.1 g完全燃烧,燃烧后的混合气体通入过量的澄清石灰水,石灰水共增重7.1g,经过滤得到l0 g沉淀。该有机样品可能是
| A.乙烯 | B.乙醛 | C.乙酸 | D.乙二醇 |
某些芳香族化合物的分子式均为C7H8O,其中液态时能与金属Na反应产生H2和不反应产生H2的结构分别有( )
| A.2种和1种 | B.2种和3种 | C.3种和2种 | D.4种和1种 |
总质量一定时,不论以任何比例混合,完全燃烧生成CO2与H2O的量为定值的是( )
A. 和C2H4 和C2H4 |
B.C2H4和C3H8 |
| C.CH2O和C2H4O2 | D.C3H8O和C2H6O |
下列比较错误的是( )
| A.密度:1-溴甲烷<1-溴乙烷<1-溴丙烷 |
| B.等物质的量的醇与足量Na反应生成氢气的量:甲醇<乙二醇<丙三醇 |
| C.沸点:邻二甲苯>间二甲苯>对二甲苯 |
| D.在水中溶解性:乙醇>正丁醇>正十二醇 |
一定量醇等分成两份,取一份充分燃烧,可生成0.2molCO2,另一份与足量钠作用放出0.1 mol H2,则该醇不可能是( )
| A.甲醇 | B.乙二醇 | C.2-丙醇 | D.甘油 |
为了证明乙醇分子中含有氧原子,现采用一套装置进行实验,试根据下列装置中的试剂及实验现象,回答有关问题:
(1)装置中所装的试剂:①A瓶装无水乙醇,内放无水盐X;
②B干燥管里装生石灰;
③C和D中都装浓H2SO4;
④E瓶装试剂Y;
(2)实验现象及操作:用水浴加热A瓶:将D中浓H2SO4缓缓滴入E中与试剂Y作用,发现C中导管有大量气泡放出;A瓶内X逐渐变色,从B中挥发出的气体可点燃。
回答下列问题:
(1)E瓶里所装的试剂Y是____________。
①饱和食盐水 ②MnO2和NaCl的混合物 ③浓HCl
(2)D中浓H2SO4所起的作用是_________________,C中浓H2SO4所起的作用是__________。
(3)A瓶中发生反应的化学方程式是____________________;反应类型是___________;所生成的_________(写名称)在B出口处点燃。
(4)无水盐X宜选用__________;它能起指示剂作用的原因是____________________。
(5)此实验能证明乙醇分子中含有氧原子的理由是____________________。
(6)如果将装置中的C瓶去掉能否得出最终结论?____________________。为什么?