在100mL 0.01mol/L KCl溶液中,加入1mL 0.01mol/L AgNO3溶液,下列说法正确的是(AgCl的Ksp=1.8×10-10 mol2/L2) ( )
| A.有AgCl沉淀析出 | B.无AgCl沉淀析出 |
| C.无法确定 | D.有沉淀但不是AgCl |
一定温度下,在氢氧化钡的悬浊液中,存在如下溶解平衡关系:Ba(OH)2(s)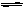 Ba2+(aq)+2OH-(aq)。向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是 ( )
Ba2+(aq)+2OH-(aq)。向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是 ( )
| A.溶液中钡离子数减小 | B.溶液中C(Ba2+)减小 |
| C.溶液中C(OH-)增大 | D.PH减小 |
向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀谈黄色,再滴入滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系 ( )
| A.AgCl=AgI=Ag2S | B.AgCl<AgI<Ag2S |
| C.AgCl>AgI>Ag2 S | D.AgI>AgCl>Ag2S |
为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是(提示:Fe(OH)3完全沉淀时的PH为3.7,Mg(OH)2完全沉淀时的PH为11.1) ( )
| A.NaOH | B.Na2CO3 | C.氨水 | D.MgO |
在含有Cl-.Br-.I-的溶液中,已知其浓度均为0.1 mol/L,而AgCl.AgBr.AgI的浓度积(mol2/L2)分别为:1.6×10-10.4.1×10-15.1.5×10-16。若向混合溶液中逐滴加入AgNO3溶液并充分搅拌时,首先析出的沉淀是_______________,最后析出的沉淀是_________;当AgBr沉淀开始析出时,溶液中Ag+的浓度是___________________
向含有AgI的饱和溶液中分别加入下列物质,请就溶液中碘离子浓度的变化做出回答。(1)加入固体AgNO3:________________________________________
(2)若改加更多的AgI固体:________________________________________
(3)若改加AgBr固体:________________________________________
欲使CaCO3在水溶液中溶解度增大,可以采用的方法是 ( )
| A.1.0mol·L-1 Na2CO3 | B.加入2.0mol·L-1 NaOH |
| C.0.10mol·L-1CaCl2 | D.降低溶液的PH值 |
下列关于沉淀溶解平衡的说法错误的是 ( )
| A.难溶电解质在水中存在沉淀溶解平衡,且是一种动态平衡 |
| B.Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关 |
| C.Ksp反映了物质在水中的溶解能力,可直接根据Ksp的数值大小比较电解质在水中的溶解能力大小 |
| D.可以通过浓度商(Qc)和Ksp的相对大小,来判断沉淀溶解平衡的移动方向 |
下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是 ( )
①热纯碱溶液的洗涤油污能力强;②误将钡盐[BaCl2.Ba(NO3)2]当作食盐食用后,常用0.5℅的Na2SO4溶液解毒;③溶洞.珊瑚的形成;④碳酸钡不能做“钡餐”而硫酸钡则能;⑤泡沫灭火器灭火的原理。
| A.②③④ | B.①②③ | C.③④⑤ | D.全部 |
下列说法正确的是 ( )
| A.硫酸钡放入水中不导电,则硫酸钡是非电解质 |
| B.物质溶于水达到饱和时,溶解过程就停止了 |
| C.绝对不溶解的物质是不存在的 |
| D.某离子被沉淀完全是指该离子在溶液中的浓度为零 |
已知Zn(OH)2的溶度积常数为1.2×10-17 mol3/L3,则它在水中的溶解度为 ( )
| A.1.4×10-6 mol/L | B.2.3×10-6 mol/L |
| C.1.4×10-9 mol/L | D.2.3×10-9 mol/L |