根据下图转化关系以及实验现象填写空白。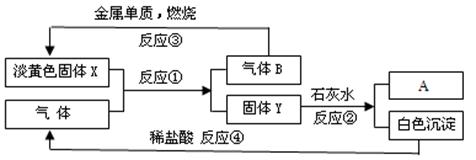
(1)固体X是_______,产物A是_______(填写化学式)。
(2)反应①的化学方程式是 ____________________。
(3)反应④的离子方程式是 _____________________________。
常温下A和B两种气体组成的混合气体(A的相对分子质量大于B的相对分子质量),经分析混合气体中只含有氮和氢两种元素,而且不论A和B以何种比例混合,氮和氢的质量比总大于14/3。由此可确定A为________,B为________,其理由是______________________________________。
若上述混合气体的氮和氢的质量比为7∶1,则在混合气体中A和B的物质的量之比为________,A在混合气体中的体积分数为________。
(14分)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(水及部分产物已略去)。
(1)若X为金属单质,W是某强酸的稀溶液。X与过量W反应生成Y的离子方程式为_________。向Z溶液中加入某种试剂_______(填试剂名称或化学式),若出现蓝色沉淀,即可判断Z溶液中阳离子的存在。
(2)若X为非金属单质,W是空气的主要成分之一。它们之间转化的能量变化如图A所示,则X+W→Z的热化学方程式为_______。
(3)若X、Y为正盐,X的水溶液显酸性,W为一元强碱(化学式为MOH),Z的电离方程式为_______。室温下,若用0.1 mol/L的W溶液滴定V mL 0.1 mol/L HA溶液,滴定曲线如图B所示,则a、b、c、d四点溶液中水的电离程度最大的是______点;a点溶液中离子浓度的大小顺序为______________;取少量c点溶液于试管中,再滴加0.1 mol/L盐酸至中性,此时溶液中除H+、OH-外,离子浓度的大小顺序为______________。
(4)若X为强碱,常温下W为有刺激性气味的气态氧化物。常温时,将Z的水溶液露置于空气中,请在图C中画出其pH随时间(t)的变化趋势曲线图(不考虑水的挥发)。
下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液。各物质间的转化如下图所示,回答下列各问题(部分生成物未列出):
(1)写出乙的化学式 、A的电子式 、甲在周期表中位置是 ;
(2)写出G的一种用途 ;
(3)写出B与K的浓溶液反应的化学方程式: ;
(4)整个转换过程中属于氧化还原反应的数目有 个;
(5)写出反应③E与A按物质的量之比2:1的反应的离子方程式 。
(共10分)中学化学中几种常见物质的转化关系如下图所示:
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体F微粒直径大小的范围:__________。
(2)A、B、H的化学式:A________、B________、H________。
(3)①写出C的酸性溶液与双氧水反应的离子方程式:________________________。
②写出鉴定C中阳离子的实验方法和现象:_______________________。
③在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:_______________________________________________。
已知:A、B、C、D、E、F在常温下均为气体,它们有以下转化关系(部分反应条件、产物已略去)。
请回答下列问题:
(1)将A点燃后伸入到装有E的集气瓶中,可观察到的现象是_________________.
(2)C的浓溶液与黑色粉末反应生成E的化学方程式为________________________。
(3)若将溶液Ⅱ滴入到碘化钾溶液中,发生反应的离子方程式为__________________,向反应后的溶液中加入适量CCl4,充分振荡后静置,可以观察到的现象是_______________。 (4)与溶液Ⅰ比较,溶液Ⅱ中多出的物质是 (填化学式)。
(4)与溶液Ⅰ比较,溶液Ⅱ中多出的物质是 (填化学式)。
A、B、C、D为单质,其余物质为化合物。A为银白色金属,D为黑色固体非金属,X在常温下是无色液体,B、C、J在常温下为气体。分别用铂丝蘸取少许E、F、H、I溶液,在无色火焰上灼烧,火焰呈黄色。将J通入澄清石灰水,石灰水先变浑浊,继续通J一段时间,石灰水又变澄清。物质间有如下图转化关系。(图中省略部分反应物和生成物)
(1)请写出下列物质的化学式:
A: B: X: J:
(2)写出下列变化中的化学反应方程式,是离子反应的,写离子反应方程式。
①A→F ;
②X+F→B+I
(3)F在生产和生活中具有重要作用,写出F的一种用途 。
(4)如果I溶液中混有H,要除去H应加适量___ 溶液(填化学式),离子方程式为 。
(11分)如下图,A、B是中学化学里常用的物质,已知A是化合物,B是单质;E溶液中滴入KSCN溶液呈红色。试回答:
(1)B和A的浓溶液反应的条件是 ,简述常温下不易反应的原因 。
(2)写出F和G相互转化的化学方程式
F→G 。
G→F 。
(3)简述L转化为I的现象 ,该反应的化学方程式为 。
(14分,每空2分)下图表示的反应关系中,部分产物被略去。已知2 mol白色固体粉末X受热分解,恢复到室温生成白色固体A、无色液体B、无色气体C各1 mol。X、E、G的焰色反应均为黄色。
回答下列问题:
(1)写出下列物质的化学式:G______,D______。
(2)写出G与C反应生成D的化学反应方程式:____________________________。
(3)写出X+E→A的离子方程式:______________________________________。
(4)写出C与Na2O2参加反应的化学方程式:_____________________________。
0.2 mol Na2O2转移的电子数为____ ____个。
(5)写出物质X的用途(至少写出一种)_ _______。
下列框图所示的转化关系中,A、C均为常见的金属单质,A、C在冷的H的浓溶液中均会发生钝化;E为固体非金属单质。B为红色固体氧化物,X为常见的无色液体。L焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)
请回答以下问题:
(1)含碳量在0.03 %~2 %之间的C的合金,是目前世界上使用量最大的合金,这种合金是 ;
A.铝合金 B.青铜 C.镁合金 D.钢铁
(2)F的化学式为 ;
(3)I与氯气反应的离子方程式为 ;
(4)A与B生成C和D的反应是 (填“放出”或“吸收”)大量热量的反应;
(5)D与L反应的离子方程式为 。
下图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性;I是一种金属单质;F、M、N均为难溶于水的白色沉淀,其中M和N不溶于稀硝酸;C和D是两种常见的强酸。请回答下列问题:
(1)写①的化学方程式______________________________________
(2)写反应②的离子方程式__________________________________
(3)写出将A通入石灰乳的化学方程式________________________
(4)在①②③④⑤⑥中,属于氧化还原反应的有:_______________(填编号)
在下图所示的一些常见单质、化合物等物质之间的转化关系中(有些反应的条件和部分物质未全部列出),已知在常温常压下,F为红棕色气体;L为白色不溶于水的固体,它既能与盐酸反应又能与氢氧化钠反应;G是硝酸;J是无色气体,且能够使燃着的木条熄灭;A为金属单质,其氧化物具有两性;D为非金属气态单质,是大气中含量最多的物质;H为非金属固态单质,其原子核中有6个质子。
(1)化合物C的化学式为______________。
(2)物质I在生产生活中的用途有_______________(任答一条)。
(3)写出E+氧气→F的化学方程式:_________________________________________。
(4)写出A与稀盐酸反应的离子方程式:_____________________________________。
以下是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色。
(1)若F是由Na+和SO42-组成的溶液,则甲的化学式是 _____________,列举A物质的一种用途______________________________________________________________。
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为________,丁属于单质、酸、碱中的________;在I溶液中加入氢氧化钠溶液,可以观察到的现象是______________________________,
对应的离子方程式和化学方程式依次是______________________,___________________。
(3)写出G→A+C的化学方程式: ___________________________________。
(4)写出E和C反应的方程式并用单线桥法标明电子的转移方向和数目:__________。
(5)若A中混有杂质Al2O3,除去杂质的方法是加入过量的________,该反应的离子方程式为__________。
(6)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4∶1。则反应物中A、E、H2SO4的物质的量之比为________。
已知A、B、C、D、E、F、G为中学化学中常见的化合物,其中A是淡黄色固体,B是无色液体,G为红褐色沉淀。常温下甲、乙、丙为气态非金属单质,丙呈黄绿色;丁、戊为常见金属单质,其中戊是当前用量最大的金属。它们之间的转化关系如下图所示(有的反应部分产物已经略去)。请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A ,E ,戊 。
(2)F转化为C的过程中出现的现象是: 。
(3)写出②中反应的离子方程式: 。
(4)①~⑥转化中不含有氧化还原反应的是: (填序号)。
(15分:除注明分数的小题之外,其余为1分))
Ⅰ、以下是依据一定的分类标准,对某些物质与水的反应情况进行分类的分类图。请根据你所学的知识按要求填空:
(1)上述第一级分类标准(分成A、B组的依据)是:__________________
(2)D组物质包括_________________________________(填化学式)。
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为_________。
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式:___ 。
Ⅱ、下图中每一方格表示有关的一种反应物或生成物。A、C为无色气体。

(1)物质M可以是________或________,C是________,F是________。
(2)反应①的化学方程式_________________________________________。
(3)反应②的离子方程式_________________________________________。
(4)F→G的化学方程式___________________________________________。