将60℃的硝酸钾溶液降温至20℃,有晶体析出。有关该过程的说法错误的是()
| A. | 60℃时的溶液一定是硝酸钾饱和溶液 |
| B. | 20 摄氏度时的溶液一定是硝酸钾的饱和溶液 |
| C. | 硝酸钾的溶解度随温度降低而减小 |
| D. | 硝酸钾的晶体可采用降温结晶的方法得到 |
、
两种固体物质的溶解度曲线如图所示,请根据曲线图回答下列问题。
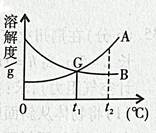
(1)现有常温下
的不饱和溶液,在只要求保持其中溶剂质量不变的条件下,将其变成饱和溶液,可行的方法有。
(2)现有一杯
时含
、
两种物质且均饱和的混合溶液,若要从中分离出少量A的纯净物,其操作方法是。
(3)下列说法正确的是。
①
时,
的溶液中溶质的质量分数一定比B的溶液中溶质的质量分数大;
② 将
,
、
的饱和溶液分别降温至
,此时两溶液中的质量分数相等;
③ 在
时,用两份等量的水分别配制成
、
的饱和溶液,这两种溶液的质量相等;
④ 在
时,用等量的
、
分别配制成两种饱和溶液,测得其质量依次为
和
,则
。
下表为氯化钠和氯化铵在不同温度时的溶解度,回答下列问题:
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
|
溶解度 |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
|
溶解度 |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
(1)由表中数据可知,溶解度随温度变化较大的物质是。
(2)20℃时,100
水最多只能溶解
,氯化钠与氯化铵溶解度相等的温度在℃之间。
(3)向烧杯中加100
水和50.0
氯化铵配成50℃的溶液,再冷却到20℃,烧杯中析出固体为
。
下列曲线能正确表达对应的反应或过程的是()

| A. | 向一定量的水中加入生石灰 | B. | 红磷在装有空气的密闭容器中燃烧 |
| C. | 向一定量的烧碱溶液中加入盐酸 | D. | 向饱和 溶液中加入 固体 |
下列有关溶液的说法正确的是
| A. | 配制好6%的 溶液,装瓶时不小心撒漏一部分,瓶中 溶液浓度仍为6% |
| B. | 长期放置后不会分层的液体一定是溶液 |
| C. | 饱和溶液一定比不饱和溶液溶质质量分数大 |
| D. | 降低饱和溶液的温度,一定有晶体析出 |
0.2%~0.5%的过氧乙酸[化学式(
)]溶液是一种杀菌能力强的高效消毒剂。
(1)过氧乙酸分子中
、
、
原子的个数比为;
(2)欲配制0.4%的过氧乙酸溶液1000g,需用20%的过氧乙酸溶液克。
、
、
在不同溶剂中的溶解度如下表所示。
表1
、
、
分别在水中的溶解度(
)
|
/℃ |
|||
| 0 |
42 |
7.1 |
35.7 |
| 10 |
51 |
12.2 |
35.8 |
| 20 |
109 |
21.8 |
36.0 |
| 30 |
119 |
39.7 |
36.3 |
表2 常温下,
、
、
分别在乙醇中的溶解度(
)
| 17.3 |
<0.01 |
0.1 |
根据表1和表2提供的数据回答下列问题:
(1)
在水中的溶解度随温度升高而(填"增大"或"减小")
(2)20℃时,饱和食盐水中溶质的质量分数为(计算结果精确到0.1﹪);
(3)为证明
能与
发生反应,小明同学将
通入饱和
的乙醇溶液中。请推测该实验可观察到的现象,推测依据是。
溶解度是物质溶解性的定量表示,溶解度曲线可表示物质在不同温度下的溶解度。甲、乙两种物质的溶解度曲线如图所示,根据图示回答下列问题:

(1)甲、乙两种物质中溶解度受温度影响较大的是 物质。
(2)若甲物质中混有少量的乙物质,提纯甲物质最好采取的方法是 (填“降温结晶”或“蒸发结晶”)。
(3)t2℃时,乙物质的溶解度为 g;t2℃时,若将30g乙物质加入到50g水中,所得溶液的溶质质量分数是 (计算结果精确到0.1%)。
(4)将t1℃的甲、乙两物质的饱和溶液(均无固体物质剩余)升温到t2℃时,所得甲物质溶液的溶质质量分数 乙物质溶液的溶质质量分数(填“大于”“小于”“等于”之一)。
用固体氯化钠配制50g溶质质量分数为6%的氯化钠溶液。下列有关做法正确的是
| A.将3.0g氯化钠直接放在托盘天平左盘上称量 |
| B.用10mL量筒量取所需水的体积 |
| C.选择的玻璃仪器是:烧杯、量筒、玻璃棒、胶头滴管、试剂瓶 |
| D.可选用内壁附有水珠的烧杯来配制溶液 |
甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法正确的是()

| A. | 甲物质的溶解度大于乙物质的溶解度 |
| B. | 时,甲、乙两种物质各50g分别加入到100g水中,充分溶解,得到的溶液质量都是140g |
| C. | 时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数 |
| D. | 时甲、乙的饱和溶液降温到 时,析出晶体的质量甲一定大于乙 |
(1)在H、C、O、Ca四种元素中,选择适当的元素组成符合下列要求的物质。(填写化学式)
①沼气的主要成分 ,
②最常见的溶剂
③可被人体直接吸收的糖 ,
④常用的食品干燥剂
(2)水和空气是人类赖以生存的自然资源。
①下列有关水和空气的叙述中正确的是
A.人们饮用的纯净水中不含任何化学物质
B.水是生命之源,保护水资源包括防止水体污染和节约用水两方面
C.目前计入空气质量日报的主要污染物中已包括了二氧化碳
D.充分利用太阳能、氢能等清洁能源可减少酸雨、温室效应等环境问题的发生
②铁制品在空气中易锈蚀,其实质是铁与空气中的 等接触后发生了化学反应。
③溶解了较多的可溶性钙和镁的化合物的水属于硬水,生活中一般可用 的方法来降低水的硬度。
④实验室欲将50g质量分数为6%的氯化钠溶液稀释为3%的稀溶液,需加水的体积为 _mL。
下图为M、N两种固体饱和溶液溶质的质量分数(C%)随温度(t)变化的曲线,下列说法正确的是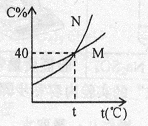
| A.50gM放入150g水中形成不饱和溶液 |
| B.t℃时,M的饱和溶液中溶质与溶剂的质量比为2:5 |
| C.80gN放入150g水中全部溶解,此时溶液的温度一定低于t℃ |
| D.100gN的溶液,蒸发15g水、冷却至t℃后得到10g晶体,原溶液溶质的质量分数为40% |
a、b 两种物质的溶解度曲线如图所示.下列说法不正确的是
| A.15℃时,60g a、b 的饱和溶液中均含有10g溶质 |
| B.加水或升温均可使b的饱和溶液变为不饱和溶液 |
| C.将 30℃时a的饱和溶液降温至15℃,溶质的质量分数变大 |
| D.向100g 水中加入20g a,升温至30℃,所得溶液为饱和溶液 |
某溶液溶质的质量分数为20%,加入50g水后变为10%,则稀释后溶液中溶质的质量是
| A.5g | B.10g | C.20g | D.50g |
配制50g溶质质量分数为15%的氯化钠溶液的实验过程中不需要用到的仪器是