空气中CO2的含量及有效利用,已经引起各国的普遍重视
Ⅰ: 目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示。

(1)前3min内,平均反应速率v(H2)= mol·L-1·min-1。此温度下该反应的平衡常数为 (保留两位小数,注意要写单位)。
(2)下列措施中,既能使反应加快,又能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入惰性气体
C.将H2O(g)从体系中分离 D.再充入1mol H2
(3)图乙中t5时引起平衡移动的条件是 。(填序号)

A.升高温度 B.增大反应物浓度 C.使用催化剂 D.增大体系压强
(4)反应达到平衡后,若向反应体系再加入CO2(g)、H2(g) 、CH3OH(g)、H2O(g)各1mol,化学平衡 (填“正向”、“逆向”或“不”)移动。
Ⅱ:利用CO2(g)+CH4(g) 2CO(g)+2H2(g)将CO2转化成燃料气。T℃时,在恒容密闭容器中通入物质的量均为0.1 mol的CH4与CO2,发生上述反应,吸收热量Q1kJ,测得CH4的平衡转化率与温度及压强的关系如图所示
2CO(g)+2H2(g)将CO2转化成燃料气。T℃时,在恒容密闭容器中通入物质的量均为0.1 mol的CH4与CO2,发生上述反应,吸收热量Q1kJ,测得CH4的平衡转化率与温度及压强的关系如图所示

(5)下列事实能说明该反应达到平衡的是( )
a.CO的物质的量不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO2)= 2v逆(H2)
d.混合气体压强不再发生变化
e.单位时间内生成n mol CH4的同时消耗2n mol H2
(6)据图可知P1、P2、P3、P4由小到大的顺序是 。
(7)若将上述容器改为恒压容器(反应前体积相同),起始时通入物质的量均为0.1 mol的CH4与CO2,相同的温度下充分反应达到平衡后,放出热量Q2 kJ,
则Q1 Q2(填 “>”“=”或“<”)
Ⅲ: 设反应①Fe(s)+CO2(g) FeO(s)+CO(g) 和反应②Fe(s)+H2O(g)
FeO(s)+CO(g) 和反应②Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数分别为K1、K2,在不同温度下, K1、K2的值如下表所示:
FeO(s)+H2(g)的平衡常数分别为K1、K2,在不同温度下, K1、K2的值如下表所示:
| T(K) |
K1 |
K2 |
| 973 |
1.47 |
2.36 |
| 1173 |
2.15 |
1.67 |
(8)现有反应CO2(g)+H2(g) CO(g)+H2O(g),是 (填“吸”或“放”)热反应。
CO(g)+H2O(g),是 (填“吸”或“放”)热反应。

 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
 下图中A、B、C、D、E、F、G均为有机化合物。
下图中A、B、C、D、E、F、G均为有机化合物。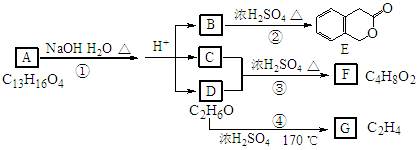

 B分子中含氧官能团的名称是。
B分子中含氧官能团的名称是。 。
。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号