某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。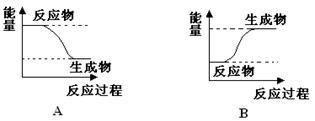
(1)若E1>E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图___________(填“A”或“B” )表示。
(2)若E1<E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图__________(填“A”或“B” )表示。
某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。
(1)若E1>E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图___________(填“A”或“B” )表示。
(2)若E1<E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图__________(填“A”或“B” )表示。