对气体的转化与吸收的研究,有着实际意义。
(1)一定条件下,工业上可用CO或CO2与H2反应生成可再生能源甲醇,反应如下:
3H2(g)+CO2(g) CH3OH(g)+H2O(g) △H1=-49.0KJ/mol K1(Ⅰ)
CH3OH(g)+H2O(g) △H1=-49.0KJ/mol K1(Ⅰ)
2H2(g)+CO(g) CH3OH(g) △H2=-90.8KJ/mol K2(Ⅱ)
CH3OH(g) △H2=-90.8KJ/mol K2(Ⅱ)
则CO(g)+H2O(g) CO2(g)+H2(g)的△H3= KJ/mol和K3= (用K1和K2表示)
CO2(g)+H2(g)的△H3= KJ/mol和K3= (用K1和K2表示)
(2)在一定温度下,将0.2mol CO2和0.8mol H2充入容积为2L的密闭容器中合成CH3OH(g)。
5min达到平衡时c(H2O)=0.025mol/L,则5min内v(H2)= _______mol/(L·min)。下图图像正确且能表明该反应在第5min时一定处于平衡状态的是______。
若改变某一条件,达到新平衡后CO2的浓度增大,则下列说法正确的是_______。
a.逆反应速率一定增大 b.平衡一定向逆反应方向移动
c.平衡常数不变或减小 d.CO2的物质的量可能减小
(3)反应II可在高温时以ZnO为催化剂的条件下进行。实践证明反应体系中含少量的CO2有利于维持ZnO的量不变,原因是_________(写出相关的化学方程式并辅以必要的文字说明;已知高温下ZnO可与CO发生氧化还原反应)。
(4)实验室里C12可用NaOH溶液来吸收。室温下,若将一定量的C12缓缓通入0.2mol/L NaOH溶液中,恰好完全反应得溶液A,反应过程中水的电离程度________(填“变大”、“变小”或“不变”,下同),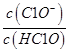 _________。溶液B为0.05mol/L的(NH4)2SO4溶液,则A、B两溶液中c(ClO-)、c(Cl-)、c(NH4+)、c(SO42-)由大到小的顺序为_________(已知:室温下HClO的电离常数Ka=3.2×10-8, NH3·H2O的电离常数Kb=1.78×10-5)。
_________。溶液B为0.05mol/L的(NH4)2SO4溶液,则A、B两溶液中c(ClO-)、c(Cl-)、c(NH4+)、c(SO42-)由大到小的顺序为_________(已知:室温下HClO的电离常数Ka=3.2×10-8, NH3·H2O的电离常数Kb=1.78×10-5)。
 CO2(g)+H2(g)的平衡常数随温度的变化如下表:
CO2(g)+H2(g)的平衡常数随温度的变化如下表: pC(g)+qD(g)已知:平均反应速率VC=VA/2;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。回答下列问题:
pC(g)+qD(g)已知:平均反应速率VC=VA/2;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。回答下列问题: pC在某温度下达到平衡。
pC在某温度下达到平衡。 粤公网安备 44130202000953号
粤公网安备 44130202000953号