为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。(相对原子质量:C=12 O=16 Ca=40)
【方案Ⅰ】如图: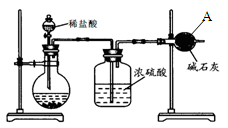
①称取碳酸钙样品m g;
②加入过量盐酸;
③测定仪器A的增重为a g。
(1)仪器A的名称是____________。
【方案Ⅱ】
①称取碳酸钙样品5.0 g;
②用1.00 mol/L盐酸100.0 mL(过量)溶解样品;
③取溶解后溶液体积的1/10 用0.1000mol/L NaOH溶液滴定,重复滴定三次,平均用去15.00mL。
(2)该碳酸钙样品的纯度= 。(计算结果保留三位有效数字)
【方案Ⅲ】
①称取碳酸钙样品mg;
②高温煅烧1000 ℃直至质量不再改变,冷却后称量,固体质量为m’g。
(3)本方案中的“冷却”应在干燥器中进行,理由是 。
【方案Ⅳ】
①称量碳酸钙样品m g;
②加入足量c mol/L盐酸V mL使之完全溶解;
③过滤并取滤液;
④在滤液中加入过量c ’mol/LNa2CO3溶液V’ mL;
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重为b g。
(4)此方案中不需要的数据是(填字母序号) 。
| A.m | B.c、V | C.c’、V’ | D.b |
(5)综上所述,你认为四个方案中,最好的方案是 。写出其它一个方案的缺点:(如:方案Ⅳ;沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差。)
方案 ; 。
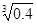 = -0.1 lg
= -0.1 lg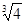 =0.2)
=0.2)
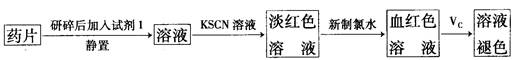

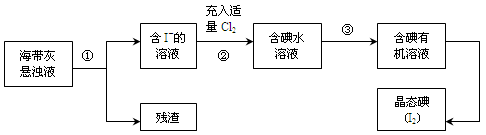
 粤公网安备 44130202000953号
粤公网安备 44130202000953号