按要求回答下列问题。
(1)SO2是形成酸雨的罪魁祸首。 64 g SO2的物质的量为 ,在标准状况下的体积约为 ,所含原子数为 。
(2)写出除去下列物质所含杂质(括号内为杂质)所用的试剂或方法:
①Na2CO3固体(NaHCO3) ②FeCl3溶液(FeCl2)
③Mg粉(Al) ④CO2(SO2)
 2NH3实现储氢和输氢。下列说法正确的是(多项选择)。
2NH3实现储氢和输氢。下列说法正确的是(多项选择)。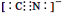
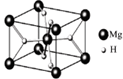
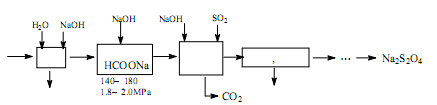
 ,其平衡常数表达式为K=。
,其平衡常数表达式为K=。 粤公网安备 44130202000953号
粤公网安备 44130202000953号