工业合成有机物F路线如下: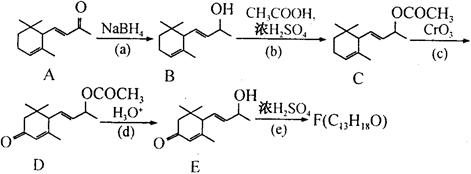
(1)有机物D中含氧的官能团名称为 和 。
(2)化合物F的结构简式是 。
(3)在上述转化关系中,设计步骤(b)和(d)的目的是 。
(4)写出步骤(d)的化学反应方程式 。
(5)写出同时满足下列条件的D的一种同分异构体的结构简式 。
| A.属于芳香化合物 | B.核磁共振氢谱有四个峰 |
| C.1mol该物质最多可以消耗2molNaOH | D.能发生银镜反应 |
(6)已知: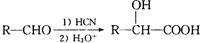 ,写出以乙醇和
,写出以乙醇和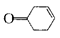 为原料制备
为原料制备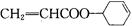 的合成路线图(无机试剂任选)。合成路线流程图示例如下:
的合成路线图(无机试剂任选)。合成路线流程图示例如下: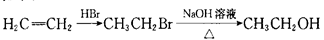
 pC达到平衡,若:
pC达到平衡,若: CH3OH(g)
CH3OH(g)
 其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的
其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的 是______________________。
是______________________。 CO2(g)+H2(g) ΔH <0
CO2(g)+H2(g) ΔH <0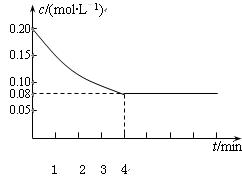

 粤公网安备 44130202000953号
粤公网安备 44130202000953号