肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体。
(1)肉桂酸甲酯由C、H、O三种元素组成,质谱分析其分子的相对分子质量为162,核磁共振氢谱谱图显示有6个峰,其面积之比为1︰2︰2︰1︰1︰3 ,利用红外光谱仪检测其中的某些基团,测得红外光谱如下图:
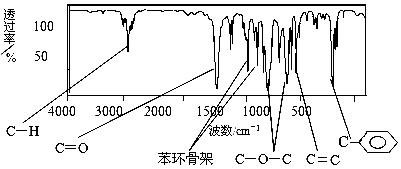
则肉桂酸甲酯的结构简式是 (不考虑立体异构)。
(2)已知:
I.醛与醛能发生反应,原理如下:
|

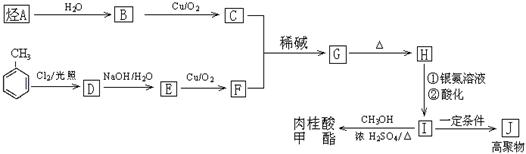
请回答:
①化合物J的结构简式为 ;
②化合物G中的官能团有 ;
③G→H为 反应(填反应类型);
④写出反应D→E的化学方程式 ;
H→I的反应 (能、否)改用酸性高锰酸钾溶液,简述理由: ;
⑤符合下列条件的I的同分异构体共有5种。写出另两种同分异构体的结构简式:
A.能发生水解反应 B.与银氨溶液作用出现光亮的银镜C.能与溴发生加成反应
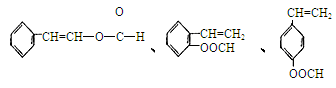

、
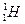 、
、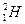 、
、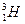 三种核素,氧
三种核素,氧 元素也有
元素也有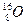 、
、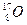 、
、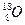 三种核素,则它们所形成的水分子共有种。
三种核素,则它们所形成的水分子共有种。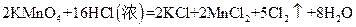
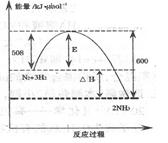
 2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。 施是。
施是。 B.升高温度
B.升高温度
 溶液、Na
溶液、Na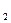 CO
CO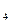 溶液和NaCl溶液,就如何检验这四种溶液分别回答下列各题:
溶液和NaCl溶液,就如何检验这四种溶液分别回答下列各题: 四支试管中分别取四种溶液各1mL,做下列实验。
四支试管中分别取四种溶液各1mL,做下列实验。
 的路线:
的路线: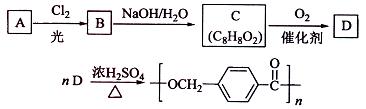

 粤公网安备 44130202000953号
粤公网安备 44130202000953号