氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
⑴下图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答: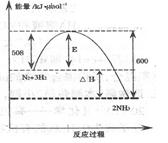
对于合成氨的反应下列说法正确的是 (填编号)。
A.该反应在任意条件下都可以自发进行
B.加入催化剂,能使该反应的E和△H都减小
C.若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1>K2
D.该反应属于人工固氮
⑵现在普遍应用的工业合成氨的方法为N2+3H2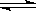 2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措 施是 。
施是 。
A.使用的更高效催化剂  B.升高温度
B.升高温度
C.及时分离出氨气 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生N2+3H22NH3的反应,下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)= 。
从11min起,压缩容器的体积为1L,则n(N2)的变化曲线为 。
A. a B.b C.c D.d
⑶随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通人一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质里,用吸附在它内外表面上的金属钯多晶薄膜作电极,实现了常压、570℃条件下高转化率的电解法合成氮(装置如上图)。则电解池阴极上的电极反应式是
 粤公网安备 44130202000953号
粤公网安备 44130202000953号