(1)在A~F中:
| A.11H和21H |
| B.甲烷和己烷 |
| C.金刚石和石墨 |
| D.正丁烷和异丁烷 |
E.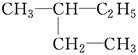 和
和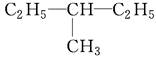
F.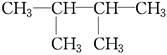 和
和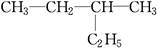
①属于同分异构体的是________,②属于同位素的是________,③属于同素异形体的是________,④属于同一种物质的是________。
(2)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式______,并写出其所有可能的结构简式__________________。
(1)在A~F中:
| A.11H和21H |
| B.甲烷和己烷 |
| C.金刚石和石墨 |
| D.正丁烷和异丁烷 |
E. 和
和
F.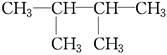 和
和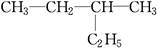
①属于同分异构体的是________,②属于同位素的是________,③属于同素异形体的是________,④属于同一种物质的是________。
(2)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式______,并写出其所有可能的结构简式__________________。