已知溴乙烷跟氰化钠(NaCN)反应后再水解可以得到丙酸:
CH3CH2Br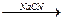 CH3CH2CN
CH3CH2CN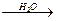 CH3CH2COOH
CH3CH2COOH
产物分子比原化合物分子多了一个碳原子,增长了碳链,请根据以下框图完成问题: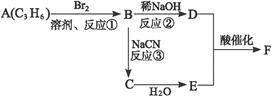
(F分子中含有8个原子组成的环状结构)
(1)反应①②③中属于取代反应的是____________(填反应代号)。
(2)写出结构简式:E.__________________________,F.___________________________。
已知溴乙烷跟氰化钠(NaCN)反应后再水解可以得到丙酸:
CH3CH2Br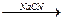 CH3CH2CN
CH3CH2CN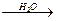 CH3CH2COOH
CH3CH2COOH
产物分子比原化合物分子多了一个碳原子,增长了碳链,请根据以下框图完成问题:
(F分子中含有8个原子组成的环状结构)
(1)反应①②③中属于取代反应的是____________(填反应代号)。
(2)写出结构简式:E.__________________________,F.___________________________。