如图所示a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体。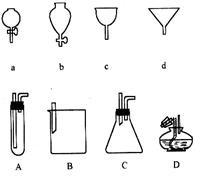
① A与 组合,用于 ,
② B与 组合,用于 ,
③ B与 组合,用于 ,
④ D与 组合,用于 ,
如图所示a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体。
① A与 组合,用于 ,
② B与 组合,用于 ,
③ B与 组合,用于 ,
④ D与 组合,用于 ,