工业上用重铬酸钠()结晶后的母液(含少量杂质)生产重铬酸钾(),工艺流程及相关物质溶解度曲线如图:
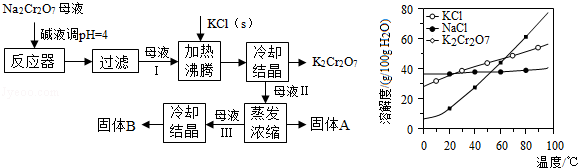
(1)由生产的化学方程式为,通过冷却结晶析出大量的原因是.
(2)向母液中加碱液调的目的是 .
(3)固体主要为(填化学式),固体主要为(填化学式).
(4)用热水洗涤固体,回收的洗涤液转移到母液(填"Ⅰ""Ⅱ"或"Ⅲ")中,既能提高产率又可使能耗最低.
工业上用重铬酸钠()结晶后的母液(含少量杂质)生产重铬酸钾(),工艺流程及相关物质溶解度曲线如图:

(1)由生产的化学方程式为,通过冷却结晶析出大量的原因是.
(2)向母液中加碱液调的目的是 .
(3)固体主要为(填化学式),固体主要为(填化学式).
(4)用热水洗涤固体,回收的洗涤液转移到母液(填"Ⅰ""Ⅱ"或"Ⅲ")中,既能提高产率又可使能耗最低.