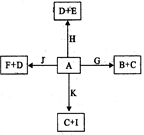
在下列物质:烧碱,NH3·H20,SO3,铁片,石墨,甲烷,醋酸,碳酸钙中,属于电解质的是 ,其中属于强电解质的是 ,既不属于电解质又不属于非电解质的是 。
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.3
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
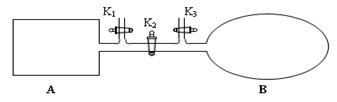
 N2O4已经达到平衡。
N2O4已经达到平衡。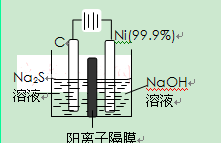
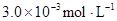 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
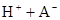
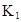
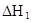
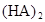
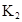
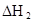
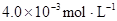
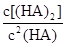 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。