[化学--选修3:物质结构与性质]
我国科学家最近成功合成了世界上首个五氮阴离子盐 (用R代表)。回答下列问题:
(1)氮原子价层电子的轨道表达式(电子排布图)为_____________。
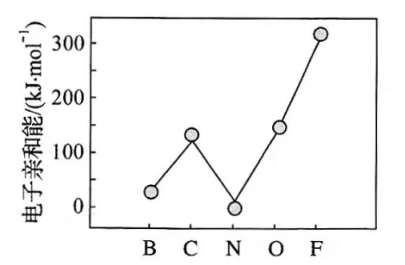
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能( E 1)。第二周期部分元素的 E 1变化趋势如下图所示,其中除氮元素外,其他元素的 E 1自左而右依次增大的原因是___________;氮元素的 E 1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。
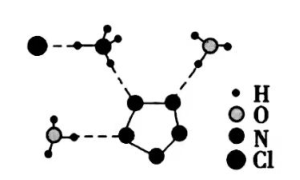
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型B.中心原子的价层电子对数
C.立体结构D.共价键类型
②R中阴离子 中的σ键总数为________个。分子中的大π键可用符号 表示,其中 m代表参与形成大π键的原子数, n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则 中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为( )N−H…Cl、____________、____________。
(4)R的晶体密度为 ,其立方晶胞参数为 anm,晶胞中含有 y个[ ]单元,该单元的相对质量为 M,则 y的计算表达式为______________。
[化学--选修3:物质结构与性质]
研究发现,在 低压合成甲醇反应 中, 氧化物负载的 氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1) 基态原子核外电子排布式为________。元素 与O中,第一电离能较大的是________,基态原子核外未成对电子数较多的是________。
(2) 和 分子中 原子的杂化形式分别为________和________。
(3)在 低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为________,原因是________。
(4)硝酸锰是制备上述反应催化剂的原料, 中的化学键除了 键外,还存在________。
(5) 具有 型结构(如图),其中阴离子采用面心立方最密堆积方式, 射线衍射实验测得 的晶胞参数为 ,则 为________ 。 也属于 型结构,晶胞参数为 ,则 为________ 。

锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能 ________ (填"大于"或"小于")。原因是________。
(3) 具有较高的熔点(872 ℃),其化学键类型是________; 不溶于有机溶剂而 、 、 能够溶于乙醇、乙醚等有机溶剂,原因是________。
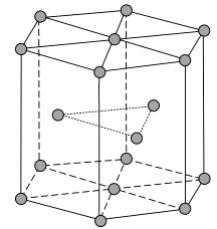
(4)《中华本草》等中医典籍中,记载了炉甘石( )入药,可用于治疗皮肤炎症或表面创伤。 中,阴离子空间构型为________,C原子的杂化形式为________。 (5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为________。六棱柱底边边长为 acm,高为 ccm,阿伏加德罗常数的值为 , Zn的密度为________ (列出计算式)。
下列叙述正确的是( )
| A. |
24g镁与27g铝中,含有相同的质子数 |
B. |
同等质量的氧气和臭氧中,电子数相同 |
| C. |
1mol重水与1mol水中,中子数比为2∶1 |
D. |
1mol乙烷和1 mol乙烯中,化学键数相同 |
Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻,能量密度大等优良性能,得到广泛应用,回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________。(填标号)
| A. |
|
| B. |
|
| C. |
|
| D. |
|
(2) 与 具有相同的电子构型, 小于 ,原因是________。
(3) 是有机合成中常用的还原剂, 中的阴离子空间构型是________。中心原子的杂化形式为________, 中,存在________(填标号)。
| A. |
离子键 |
| B. |
σ键 |
| C. |
π键 |
| D. |
氢键 |
(4) 是离子晶体,其晶格能可通过图(a)的 Born-Haber循环计算得到

可知,Li原子的第一电离能为________ , O=O键键能为________ , 晶格能为________
(5) 具有反莹石结构,晶胞如图(b)所示。已知晶胞参数为0.4665mm,阿伏加德罗常数的值为 ,则 的密度为 ________ (列出计算式)。
东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
(1)镍元素基态原子的电子排布式为________,3d能级上的未成对电子数为________.
(2)硫酸镍溶于氨水形成[Ni(NH 3) 6]SO 4蓝色溶液.
①[Ni(NH 3) 6]SO 4中阴离子的立体构型是________.
②在[Ni(NH 3) 6]SO 4中Ni 2+与NH 3之间形成的化学键称为________,提供孤电子对的成键原子是________.
③氨的沸点________(填"高于"或"低于")膦(PH 3),原因是________;氨是________分子(填"极性"或"非极性"),中心原子的轨道杂化类型为________.
(3)单质铜及镍都是由________键形成的晶体;元素铜与镍的第二电离能分别为:I Cu=1 958kJ•mol ﹣ 1、I Ni=1 753kJ•mol ﹣ 1,I Cu>I Ni的原因是________.
(4)某镍白铜合金的立方晶胞结构如图所示
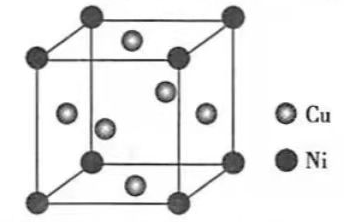
①晶胞中铜原子与镍原子的数量比为________.
②若合金的密度为d g•cm ﹣ 3,晶胞参数a=________nm.
[化学一一选修3: 物质结构与性质]
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1) 基态 Ge 原子的核外电子排布式为[Ar] ,有 个末成对电子。
(2) Ge 与 C 是同族元素, 原子之间可以形成双键、叁键, 但 原子之间难以形成双键或 叁键。从原子结构角度分析,原因是 。
(3)比较下列锗卤化物的熔点和沸点, 分析其变化规律及原因 。
|
|
|
|
|
|
熔点/ |
|
26 |
146 |
|
沸点/ |
|
186 |
约 400 |
(4) 光催化还原 制备 反应中,带状纳米 是该反应的良好催化剂。 、Ge、O 电负性由大至小的顺序是 。
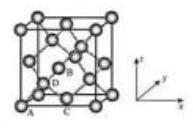
(5) Ge 单晶具有金刚石型结构, 其中 原子的杂化方式为_ , 微粒之间存在的作用力是_ 。
(6)晶胞有两个基本要素:
①原子坐标参数, 表示晶胞内部各原子的相对位置, 下图为 Ge 单晶的晶胞, 其中原子坐标参数 为 为 为 。则 原子的坐标参数为 。
②晶胞参数, 描述晶胞的大小和形状,已知 Ge 单晶的晶胞参数 , 其密度为 (列出计算式即可)。
下列关于C、Si及其化合物结构与性质的论述错误的是( )
A.键能C﹣C>Si﹣Si、C﹣H>Si﹣H,因此C2H6稳定性大于Si2H6
B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度
C.SiH4中Si的化合价为+4,CH4中C的化合价为﹣4,因此SiH4还原性小于CH4
D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p﹣pπ键
氨硼烷(NH 3BH 3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是 。根据对角线规则,B的一些化学性质与元素 的相似。
(2)NH 3BH 3分子中,N﹣B化学键称为 键,其电子对由 提供。氨硼烷在催化剂作用下水解释放氢气:
3NH 3BH 3+6H 2O═3NH 4 ++B 3O 6 3 ﹣+9H 2
B 3O 6 3 ﹣的结构为 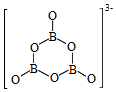 .在该反应中,B原子的杂化轨道类型由 变为 。
.在该反应中,B原子的杂化轨道类型由 变为 。
(3)NH 3BH 3分子中,与N原子相连的H呈正电性(H δ +),与B原子相连的H呈负电性(H δ﹣),电负性大小顺序是 。与NH 3BH 3原子总数相等的等电子体是 (写分子式),其熔点比NH 3BH 3 (填"高"或"低"),原因是在NH 3BH 3分子之间,存在 作用,也称"双氢键"。
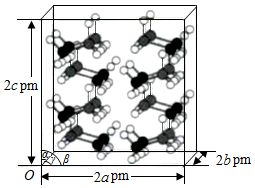
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为apm、bpm、cpm,α=β=γ=90°.氨硼烷的2×2×2超晶胞结构如图所示。氨硼烷晶体的密度ρ= g•cm ﹣ 3(列出计算式,设N A为阿伏加德罗常数的值)。