阿伏加德罗常数的值为 。下列说法正确的是( )
| A. |
溶液中, 的数量为 |
| B. |
与 完全反应,转移的电子数为 |
| C. |
标准状况下, 和 的混合气体中分子数为 |
| D. |
和 于密闭容器中充分反应后,其分子总数为 |
砷(As)是第四周期VA族元素,可以形成 、 、 、 等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图__________。
(2)工业上常将含砷废渣(主要成分为 )制成浆状,通入 氧化,生成 和单质硫。写出发生反应的化学方程式__________。该反应需要在加压下进行,原因是__________。
(3)已知:
则反应 的 __________。
(4)298K时,将 、 和 溶液混合,发生反应: 。溶液中 与反应时间(t)的关系如图所示。
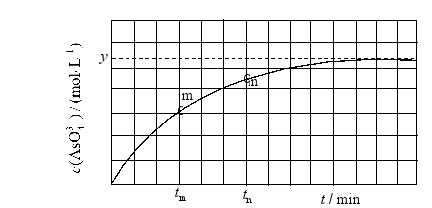
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.
c. 不再变化
d.
② 时, __________ (填"大于"、"小于"或"等于")。
③ 时 __________ 时 (填"大于"、"小于"或"等于"),理由是__________。
④若平衡时溶液的 ,则该反应的平衡常数K为__________。
重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 ,还含有硅、铝等杂质。制备流程如图所示:

回答下列问题:
(1)步骤①的主要反应为:
上述反应配平后 与 的系数比为________。该步骤不能使用陶瓷容器,原因是________。
(2)滤渣1中含量最多的金属元素是________,滤渣2的主要成分是________及含硅杂质。
(3)步骤④调滤液2的 使之变________(填"大"或"小"),原因是________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向"滤液3"中加入适量 ,蒸发浓缩,冷却结晶,过滤得到 固体。冷却到________(填标号)得到的 固体产品最多。
a.
b.
c.
d.
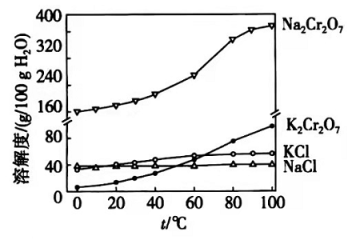
步骤⑤的反应类型是________。
(5)某工厂用 铬铁矿粉(含 40%)制备 ,最终得到产品 ,产率为________。
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加 溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:________、________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关 和 )(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
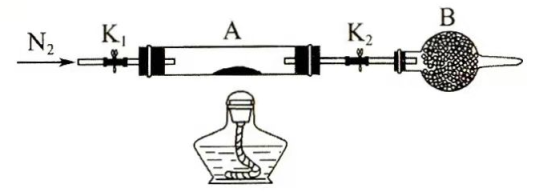
①仪器B的名称是________。
②将下列实验操作步骤正确排序________(填标号);重复上述操作步骤,直至A恒重,记为 。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭 和
d.打开 和 ,缓缓通入
e.称量Af.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目 ________(列式表示)。若实验时按a、d次序操作,则使x________(填"偏大""偏小"或"无影响")。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开 和 ,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
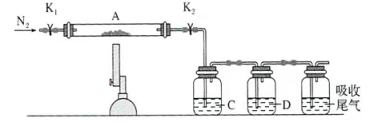
① 中的溶液依次为________(填标号)。 中有气泡冒出,并可观察到的现象分别为________。
a.品红
b.
c.
d.
e.浓
②写出硫酸亚铁高温分解反应的化学方程式________。
为阿伏加德罗常数的值。下列说法正确的是( )
| A. |
的 中,含有 个中子 |
| B. |
的 溶液中,含有 个 |
| C. |
(标准状况)苯在 中完全燃烧,得到 个 分子 |
| D. |
密闭容器中 与 反应制备 ,增加 个 键 |
设
为阿伏加德罗常数值。关于常温下pH=2的
溶液,下列说法正确的是( )
A. 每升溶液中的 数目为
B.
C. 加水稀释使电离度增大,溶液pH减小
D. 加入 固体,溶液酸性增强
立德粉
(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
| A. |
黄色 |
| B. |
红色 |
| C. |
紫色 |
| D. |
绿色 |
(2)以重晶石( )为原料,可按如下工艺生产立德粉:
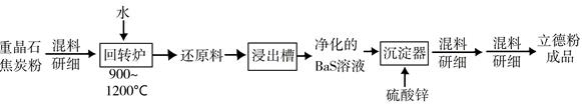
①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为________。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为 和一种清洁能源气体,该反应的化学方程式为________。
②在潮湿空气中长期放置的"还原料",会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是"还原料"表面生成了难溶于水的________(填化学式)。
③沉淀器中反应的离子方程式为________。
(3)成品中 的含量可以用"碘量法"测得。称取 样品,置于碘量瓶中,移取 l的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应 ,有单质硫析出。以淀粉溶液为指示剂,过量的 用 溶液滴定,反应式为 。测定时消耗 溶液体积 。终点颜色变化为________,样品中 的含量为________(写出表达式)。
下列化学方程式中,不能正确表达反应颜色变化的是( )
| A. |
向 溶液中加入足量Zn粉,溶液蓝色消失: |
| B. |
澄清的石灰水久置后出现白色固体: |
| C. |
在空气中放置后由淡黄色变为白色: |
| D. |
向 悬浊液中滴加足量 溶液出现红褐色沉淀: |
已知
是阿伏加德罗常数的值,下列说法错误的是( )
| A. |
含有的中子数为 |
| B. |
磷酸钠溶液含有的 数目为 |
| C. |
被还原为 转移的电子数为 |
| D. |
48g正丁烷和10g异丁烷的混合物中共价键数目为 |
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
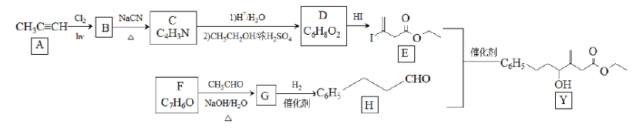
已知: 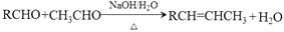
回答下列问题:
(1)A的化学名称是________。
(2)B为单氯代烃,由B生成C的化学方程式为________。
(3)由A生成B、G生成H的反应类型分别是________、________。
(4)D的结构简式为________。
(5)Y中含氧官能团的名称为________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________。
以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物。有葡萄糖为原料合成E的路线如下:
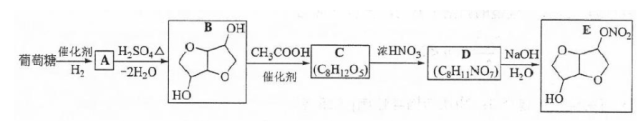
回答下列问题:
(1)葡萄糖的分子式为________.
(2)A中含有的官能团的名称为________.
(3)由B到C的反应类型为________.
(4)C的结构简式为________.
(5)由D到E的反应方程式为________.
(6)F是B的同分异构体,7.30g的F与足量饱和碳酸氢钠反应可释放出2.24L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构);其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构简式为________.
代表阿伏伽德罗常数的值,下列说法正确的是()
| A. |
常温常压下, 中所含P-P键数目为 |
B. |
溶液中所含 的数目为 |
| C. |
标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为 |
D. |
密闭容器中, 和 催化反应后分子总数为 |
W、X、Y和Z为原子序数一次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同,下列叙述正确的是()
| A. |
X与其他三种元素均可形成两种或两种以上的二元化合物 |
B. |
Y与其他三种元素分别形成的化合物中只含有离子键 |
| C. |
四种元素的简单离子具有相同的电子层结构 |
D. |
W的氧化物对应的水化物均为强酸 |
醋酸亚铬[ ]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂,一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是________,仪器a的名称是________。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开 , ,关闭 。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为________。
②同时c中有气体产生,该气体的作用是________。
(3)打开 ,关闭 和 。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是________、________、洗涤、干燥。
(4)指出装置d可能存在的缺点________。