同学们学习了分子、原子、离子是构成物质常见的基本粒子,它们的质量和体积都很小。某化学兴趣小组的同学对粒子体积大小有没有差异进行了如下探究:
【查阅资料】
鸡蛋膜有极其微小的孔隙。
【实验探究】
如图所示:向5个鸡蛋壳内分别加入下表中的物质,放入盛有蒸馏水的小烧杯中,一段时间后取出鸡蛋壳,再向小烧杯中分别加入如表中的物质进行实验。
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
鸡蛋壳内加入的物质 |
溶液 |
溶液 |
溶液 |
淀粉溶液 |
鸡蛋清 |
|
小烧杯中加入的物质 |
溶液 |
溶液 |
溶液 |
碘水 |
浓硝酸 |
|
小烧杯中的现象 |
白色沉淀 |
|
红褐色沉淀 |
无现象 |
无现象 |
【实验分析】
(1)实验①小烧杯中产生的白色沉淀是 ;实验③小烧杯中产生红褐色沉淀,反应的化学方程式为 。
(2)通过实验①②③得出的结论是 。
【实验结论】
综上实验探究可知:构成物质的基本粒子的体积 。
【反思交流】
小明同学认为上述实验④⑤不能比较分子体积大小差异,还应增加下列对比实验进行完善:将实验④鸡蛋壳内和小烧杯中物质互换,重复上述实验操作,小烧杯中的现象是 。
【拓展延伸】
科学家设计制造出孔径大小不同的“小筛子”,让体积大小不同的粒子通过,从而分离提纯物质。如天然水的净化、海水淡化。

(1)实验室制取某种气体X,X可能为氢气、氧气或二氧化碳。回答下列问题:

①图中用于加热试管的仪器名称是 。
②若将装置A和E连接制取气体X,A中反应的化学方程式为 。
③若用装置B和F制取气体X,装置中a和c相连,则气体X是 。
(2)长途运输活鱼常向水中加入过氧化钙( )固体。某探究小组对过氧化钙进行了如下探究活动。
【探究活动1】
①将一定量的过氧化钙加入水中,缓慢产生气泡(经检验该气体能使带火星的木条复燃);
②取少量反应后的液体于试管中,滴加酚酞试液,溶液变红。据此得出反应的化学方程式为 。
【探究活动2】
另取①中上层清液,加入 溶液,充分反应后有沉淀生成,生成沉淀的化学方程式为 。过滤,得到滤渣和滤液。
【提出问题】滤液中溶质的成分是什么?
【作出猜想】猜想一:
猜想二:
猜想三: 、
【实验探究】取少量滤液,向其中加入足量稀盐酸, (填写实验现象),猜想三成立。
【反思交流】根据以上探究事实,你认为过氧化钙的用途有 (写一条即可)。
燃烧与灭火紧密联系着我们的生活。请你依据下列实验探究,回答相关问题。

(1)在空气中点燃镁条,观察到镁条剧烈燃烧,发出耀眼白光,说明该反应 (填“放出”或“吸收”)能量,生成白色固体 ,说明镁发生了 反应(填“氧化”或“还原”)。
(2) 可用于灭火,是否也可熄灭燃着的镁呢?某实验小组进行了如下探究:
①实验探究
取两块大小相同的干冰,在一块干冰中央挖一个小穴,放入一些镁屑,用红热的铁棒点燃镁屑。(见图1)
迅速将另一块干冰盖上,镁在两块干冰间剧烈反应,发出耀眼的白光,像冰块中装入一个明亮的电灯泡一样。(见图2和图3)
取走上面一块干冰,观察到有白色固体产生(见图4),用铁片拨开图4产物的表面(见图5),还观察到的现象是 ,写出该反应的化学方程式 。
②反思交流
小组实验后讨论,对初中教材中燃烧的条件有了新的认识,请你代为表达。 。
我国化学家侯德榜创立的侯氏制碱法,为世界制碱工业作出了突出贡献。在工业生产所得的碳酸钠产品中往往会混有少量的氯化钠。某校化学兴趣小组同学想探究某产品中碳酸钠的质量分数,经讨论后设计了如下两种实验方案。
【查阅资料】碱石灰的主要成分是 和 。
【设计与实验】
方案甲:“气体质量法”

(1)按如图所示连接好装置,检查装置气密性后加入一定质量的碳酸钠样品于装置A中。
(2)打开止水夹K通入一段时间的氮气后,称量装置C的质量,并记录。
(3)关闭止水夹K,打开分液漏斗活塞向A装置中注入足量的稀硫酸,关闭活塞。
(4)待装置A中无气泡产生后打开止水夹K,再次通入氮气一段时间后,关闭止水夹K,第二次称量装置C的质量,并记录。
(5)计算。
【分析与讨论】
①装置A中发生反应的化学方程式为 。
②装置B中浓硫酸的作用是 。
③步骤(4)中再次通入氮气的目的是 。
④装置D的作用是 。
方案乙:“沉淀质量法”
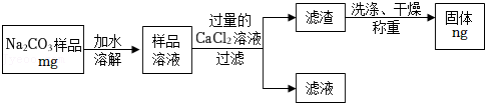
写出上述流程中相关反应的化学方程式: 。
【得出结论】
同学们经过实验,最终都计算出了样品中碳酸钠的质量分数。
请你根据方案乙中测定的相关数据,求出样品中碳酸钠的质量分数为 ×100%(用含有m、n的代数式表示)。
【反思与交流】
同学们经过讨论认为方案乙优于方案甲,理由主要是 (填字母序号)。
| A. |
节约能源 |
| B. |
操作简便 |
| C. |
保护环境 |
其兴趣小组同学在老师的指导下,进入实验室对碳酸钙进行了一系列探究。回答下列问题:
Ⅰ.碳酸钙与盐酸反应
(1)装置A中仪器a的名称为 。
(2)装置B中的现象是 。
(3)装置C若用于检验生成的气体,其中试剂为 (写名称),发生反应的化学方程式为 。
Ⅱ.碳酸钙分解
碳酸钙在电炉中高温煅烧一段时间后,对剩余固体进行探究。
【提出问题】剩余固体成分是什么?
【猜想与假设】猜想一:全部是碳酸钙
猜想二:是碳酸钙和氧化钙的混合物
猜想三:全部是氧化钙
【设计并完成实验】
|
实验操作 |
实验现象 |
解释与结论 |
|
步骤一:取剩余固体于试管中,加水振荡后静置 |
底部有白色不溶物 |
\ |
|
步骤二:取上层清液于另一试管中,滴加氯化铜溶液 |
有 |
上层清液中一定含有氢氧化钙 |
|
步骤三:取部分底部白色不溶物于第三支试管中,滴加过量稀盐酸 |
有气泡产生 |
白色不溶物中一定含有 |
【实验结论】正确的猜想是 。
【交流与反思】小芳同学认为,步骤二中还可滴加其他试剂用来替代氯化铜溶液,该试剂可以是 (写一种即可);小华同学认为,只需完成步骤一和步骤三即可获得相同实验结论,他的依据是 。
【拓展与分析】查阅资料:生石灰质量的优劣常采用“活性度”来衡量。“活性度”的测定方法:取一定质量的生石灰,加入一定量的水,用一定溶质质量分数的盐酸中和,记录所消耗盐酸的体积(单位为mL)。消耗盐酸的体积数越大,“活性度”越高。
测得煅烧产物( )的活性度,数据见如表。

石灰石煅烧的最佳温度范围一般为1100℃~1200℃的证据是 。

学习完金属的化学性质,兴趣小组进行了如图所示的实验。

【查阅资料】硝酸铜溶液呈蓝色,硝酸亚铁溶液呈浅绿色,硝酸锌溶液呈无色。
【实验一】同学们进行如图一所示的实验,验证铁、锌、铜、银四种金属活动性强弱。
(1)试管①中观察到的实验现象是 。试管③中反应的化学方程式是 。
(2)你认为通过上述图一所示的三个实验能否验证铁、锌、铜、银四种金属在溶液中的活动性强弱 (填“能”或“不能”)。
【实验二】在完成实验一的过程中,同学们将试管①②③内反应后的物质都倒入废液缸中(如图二)。小组同学对废液缸中混合物的成分产生了探究兴趣。待混合物充分反应后,过滤,得到滤渣和浅绿色滤液。
(3)小明将铁丝放入浅绿色滤液中,一段时间后,铁丝表面没有发生变化。由此判断滤液中含有的溶质是 (填化学式)。
(4)探究滤渣的成分
【提出问题】滤渣的成分是什么?
【作出猜想】小明的猜想:银、铜、铁、锌
你的猜想:猜想Ⅰ ;
猜想Ⅱ:银、铜、铁
【分析思考】同学们认为小明的猜想不正确,结合上述的实验现象分析,小明的猜想不正确的原因是 。
【进行实验】实验证明猜想Ⅱ正确,请你完成下列实验方案。
|
实验步骤 |
实验现象 |
结论 |
|
取少量滤渣样品, 。 |
。 |
猜想Ⅱ正确 |
【反思交流】在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑 。
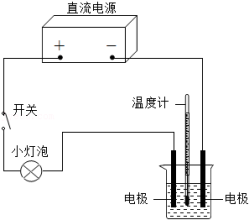
在学习人教版九年级化学下册第十单元课题1“常见的酸和碱”时,教师演示了饱和氢氧化钙溶液导电性实验,如图所示。
请根据要求回答下列问题。
实验用品:
直流电源、导线、石墨电极、灯泡、带刻度的烧杯、温度计、开关。
100mL饱和 溶液。
实验现象:
灯泡发光,两电极分别有气泡产生,烧杯内液面下降,与电源正极相连的石墨电极周围出现较多白色浑浊物,溶液温度升高。
分析:液面下降是因为水被电解。电源正极产生的气体为 (用化学式表示)。
【提出问题】溶液出现白色浑浊物的原因是什么?
【查阅资料】氢氧化钙微溶于水
【作出猜想】
猜想Ⅰ:溶液温度升高,氢氧化钙溶解度变小,溶质析出。
猜想Ⅱ: ,溶质析出。
猜想Ⅲ:石墨电极与生成气体发生反应,导致产生白色浑浊物。
【实验探究】溶液出现白色浑浊物的原因
|
实验 |
实验操作 |
实验现象 |
实验结论 |
|
① |
取相同条件下的100mL饱和 溶液于大烧杯中,加热至演示实验溶液上升的温度(温度升高约4℃)。 |
溶液中几乎无白色浑浊物。 |
猜想Ⅰ |
|
② |
将相同条件下的 mL饱和 溶液加热蒸发掉部分水(蒸发掉水的体积与演示实验减少水的体积相同)。 |
溶液中出现少量白色浑浊物。 |
猜想Ⅱ成立但不是溶液变浑浊主要原因。 |
|
③ |
向90mL相同浓度饱和 溶液中加入10mL蒸馏水,搅拌,其余条件不变,重复进行演示实验操作。 |
两电极分别有气泡冒出, 。 |
猜想Ⅲ成立且是溶液变浑浊主要原因。 |
|
④ |
使用铂电极代替石墨电极,重复进行实验③。 |
两电极分别有气泡冒出,溶液中无白色浑浊物。 |
【总结反思】
(1)白色浑浊物的成分为 (用化学式表示)。
(2)用化学方程式表示主要浑浊物的成因 。
某兴趣小组利用“盐酸、硫酸铜、氢氧化钠、碳酸钠、硝酸钾”五种溶液对“复分解反应发生的条件”进行再探究。
【知识回顾】(1)回忆向滴有酚酞试剂的氢氧化钠溶液中滴加稀盐酸的实验。
(2)观察两者反应的微观示意图(图1),该反应过程没有变化的微粒是 ,两者反应的微观实质是溶液中的 。
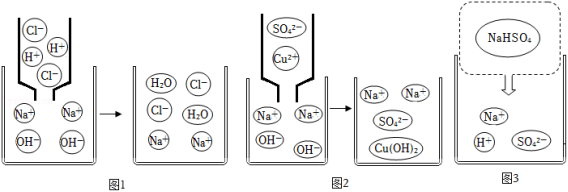
【实质再探】(1)向氢氧化钠溶液中滴加硫酸铜溶液反应的化学方程式是 ,图2是二者反应的微观示意图,两者反应的实质是溶液中的 。
(2)向碳酸钠溶液中滴加稀盐酸,产生大量气泡,实质是溶液中 反应生成了水和二氧化碳气体。
【归纳小结】复分解反应发生的微观实质是溶液中的 。
【拓展应用】(1)将碳酸钠溶液和硝酸钾溶液混合没有发生变化,分析两者不发生反应的原因是 。
(2)图3是硫酸氢钠在水中解离的微观示意图,溶液中存在的离子是 ,滴加 (用化学式表示)溶液既能降低该溶液的酸性又能生成沉淀。
松花蛋是我国特有的一种传统美食。“圆梦”学习小组进行了“松花蛋制作”的项目研究,请结合任务回答问题。
【任务一】品松花蛋,初识松花蛋的酸碱性
同学们品尝松花蛋时,发现松花蛋略有涩味,加入食醋涩味减轻,他联想到碱性物质通常有涩味,推测松花蛋中含有碱性物质。
【任务二】浸松花蛋粉,寻找涩味缘由
取适量松花蛋粉(用于制作松花蛋泥的原料),加入足量水,搅拌、过滤。测得滤液pH=12,证明滤液中含有碱性物质。
【提出问题】滤液中的碱性物质是什么?
【查阅资料】松花蛋粉中主要含有生石灰、食盐、纯碱等。
【分析推理】松花蛋粉加水调和时发生如下反应: , (写化学方程式)。
甲同学认为滤液中的碱性物质是氢氧化钠。乙同学对甲同学的说法提出了质疑,认为滤液中的碱性物质除氢氧化钠外,还可能含有 (填化学式)或氢氧化钙。
【实验探究】
|
操作 |
现象 |
结论 |
|
取滤液少许,向其中加入 |
无明显现象 |
滤液中不含 |
|
另取滤液少许,向其中加入碳酸钾溶液 |
|
滤液中含有氢氧化钙 |
通过以上探究,同学们找到了松花蛋粉加水后滤液显碱性的原因,寻到了涩味的缘由。
【反思总结】判断化学反应后溶液的成分时,既要考虑生成物、又要考虑 。
【任务三】腌松花蛋,制作传统美食
同学们戴上手套。将松花蛋粉加入容器中,慢慢加水,并不断搅拌。充分反应后冷却,得到松花蛋泥,将松花蛋泥均匀裹到新鲜鸭蛋上密封。
从安全的角度说明“慢慢加水,并不断搅拌”的目的是 。
【项目拓展】
为了使松花蛋产生美丽的松花,传统工艺中加入密陀僧(主要成分为氧化铅),目前密陀僧已逐渐被硫酸锌取代,制得无铅松花蛋。从人体健康角度分析这一工艺改进的原因是 。
探究与实践——制作松花蛋
松花蛋也叫皮蛋,是人们喜爱的食品。小明看到妈妈用皮蛋粉制作皮蛋时产生了浓厚的兴趣,于是以“皮蛋制作”为主题开展项目式学习。
(1)配制皮蛋粉
在妈妈的指导下,小明将“石灰”、纯碱和食盐按照一定比例混合,制成皮蛋粉。
【提出问题】配料中所用“石灰”是生石灰还是熟石灰?
【查阅资料】相同条件下,生石灰、熟石灰与水混合后均能放出热量,但放出的热量不同。
【实验探究】常温下,将“石灰”、生石灰和熟石灰分别加入水中,测量固体加入前后温度的变化情况。实验过程中需要保持不变的量是 。
【数据分析】根据数据比对,可知配料中的“石灰”为生石灰。
(2)浸鲜蛋
向配制的皮蛋粉中加入一定量的水,充分反应后过滤,所得滤液称为浸出液,将新鲜鸭蛋放入其中浸泡即可。
①向皮蛋粉中加水时,发生反应的化学方程式为 。
②妈妈告诉小明,制作过程中一定要戴上胶皮手套。分析上述过程,小明认为浸出液中一定含有会腐蚀皮肤的物质是 (填化学式)。
③浸出液中还含有哪些溶质?小明进行了如下探究,请完成如表(不考虑生石灰中杂质的影响)
|
预测假设 |
实验方案 |
实验现象 |
实验结论 |
|
浸出液中含碳酸钠 |
|
|
浸出液中不含碳酸钠 |
|
浸出液中含氢氧化钙 |
|
|
浸出液中含有氢氧化钙 |
④综合分析,确定皮蛋浸出液中的溶质有(写化学式) 。
(3)品皮蛋
制作过程中,碱液会渗入皮蛋使之略带涩味。妈妈告诉小明食用时可以蘸少量食醋去除涩味,该化学反应的微观实质是 ,此反应实质在生产生活中应用广泛,请再列举一例 。

小明同学在整理实验室时发现了一瓶敞口放置的氢氧化钠溶液,他认为该溶液可能变质了,于是邀来小琳和小可,对该溶液中溶质成分进行实验探究。
【猜想与假设】
小可认为该溶液中溶质是 ;
小琳认为该溶液中溶质是 ;
小明却认为该溶液中溶质是 (填化学式)。
【查阅资料】氯化钡溶液显中性:碳酸钡难溶于水。
【进行实验】
|
实验 |
实验操作 |
实验现象 |
|
① |
小可取适量该溶液,滴入几滴无色酚酞溶液 |
溶液变红色 |
|
② |
小琳取适量该溶液,滴入几滴氯化钡溶液 |
产生白色沉淀 |
|
③ |
小明取适量该溶液,滴入过量氯化钡溶液 |
产生白色沉淀 |
|
④ |
小明取适量实验③所得的上层清液,滴入几滴无色酚酞溶液 |
溶液变红色 |
【实验结论】
(1)根据实验①和②可以得出结论:该溶液中一定含有的溶质是 (填化学式)。 同学的猜想一定是错误的,原因是 。
(2)根据实验③和④,你认为小明同学的猜想 (填“正确”或“错误”)。
【反思与交流】
(1)氢氧化钠溶液变质的原因是(用化学方程式表示) 。
(2)实验室为了防止氢氧化钠溶液变质,正确的措施是 (写出一条即可)。
学习复分解反应后,某化学兴趣小组的同学对初中化学常见的四种物质稀盐酸、 粉末、 溶液、 溶液之间的反应进行如图所示的实验探究。

(1)大家一致认为试管①中不发生复分解反应,理由是 。
(2)试管②中观察到的现象是 。试管③中发生反应的化学方程式为 。
(3)将试管③反应后的物质过滤,对滤液中溶质的成分进一步探究:
【提出问题】滤液中溶质的成分是什么?
【猜想假设】猜想一:
猜想二: 、
猜想三:
【设计实验】
|
实验操作 |
实验现象 |
结论 |
|
步骤一:取少量滤液于试管中,加入适量 溶液 |
无明显现象 |
猜想 不成立 |
|
步骤二:取少量滤液于试管中,加入适量稀硫酸 |
有白色沉淀生成 |
猜想三成立 |
【反思拓展】
Ⅰ.探究反应后溶液中溶质的成分,既要考虑生成物,又要考虑反应物是否有剩余。
Ⅱ.依据复分解反应发生的条件,步骤二中除可用稀硫酸外,还可选用 (填字母序号)也能达到同样的实验目的。
a.稀盐酸
b.氢氧化钠溶液
c.碳酸钠溶液
某地区有盐碱地分布,化学兴趣小组针对盐碱地成分展开探究。
【猜想与假设】在老师的指导下,同学们认为盐碱地土壤中可能含有:
①碳酸钠②碳酸氢钠③氢氧化钠
【查阅资料】
(1)碳酸氢钠受热容易分解,生成碳酸钠、水和二氧化碳;
(2)氯化钙溶液呈中性;
(3)碳酸氢钙可溶于水。
【设计与实验一】甲同学取少量盐碱地土壤于烧杯中,加入适量的蒸馏水,充分搅拌混合后过滤,将所得滤液分成三等份,依次编号为1号、2号和3号,进行如下实验。
|
实验步骤 |
实验现象 |
实验结论 |
|
取1号滤液滴加足量稀盐酸 |
﹣﹣﹣ |
滤液里可能含有碳酸钠,也可能含有碳酸氢钠 |
|
取2号滤液滴加 溶液 |
|
滤液里一定含有碳酸钠。 相关化学方程式是 |
实验结论:盐碱地土壤中含有碳酸钠。
【设计与实验二】乙同学设计如图所示装置并实验。
实验结论:盐碱地土壤中不含碳酸氢钠。得出该结论所依据的实验现象是 。
【设计与实验三】丙同学设计实验如下。
|
实验步骤 |
实验现象 |
实验结论 |
|
取3号滤液 |
|
盐碱地土壤中不含氢氧化钠 |
【反思与交流】丁同学经过思考,认为盐碱地土壤长期暴露在空气中不可能含有氢氧化钠,他的理由是
(用化学方程式表示)。

某化学兴趣小组用大理石和盐酸制取 ,将产生的气体通入到澄清石灰水中,未见浑浊现象。为查明原因,请你参与小组探究并完成相关任务。
【提出问题】澄清石灰水未变浑浊的原因是什么
【假设猜想】猜想一:石灰水变质
猜想二:制得气体中无
猜想三: 中混有 气体
【实验探究】为探究猜想是否成立,小组同学取原实验药品设计如下实验:
|
实验操作 |
|
|
|
实验现象 |
石灰水变浑浊 |
b试管溶液变浑浊 |
|
实验结论 |
猜想二不成立 |
【验证实验】为验证猜想三是否成立,小组又进行如下实验
|
实验操作 |
|
|
|
实验现象 |
试管内产生白色沉淀 |
紫色石蕊溶液变红 |
|
实验结论 |
猜想三成立 |
【问题解释】实验I中石灰水变浑浊的原因 (用化学方程式表示)。
【评价反思】组内有成员提出,为验证猜想三是否成立,无需做实验Ⅳ,紫色石蕊溶液变红,无法证明确实有HCl的存在,你的解释是 (用化学方程式表示)。
【实验改进】查明原因后,小组成员对原实验设计进行了改进并重新操作,现象明显。他们改进的措施是 。
人类研发使用可降解塑料,是防治“白色污染”的重要途径之一。某化学兴趣小组查阅资料得知,以聚乳酸为原料加工而成的一种餐具能被自然界中微生物完全降解,最终生成二氧化碳和水。该小组对这种餐具组成元素进行探究。请回答下列问题。
【提出问题】这种餐具的组成元素是什么?
【提出猜想】猜想1:这种餐具由碳、氢元素组成,猜想2:这种餐具由 元素组成。
【查阅资料】硫酸铜粉末吸水由白色变为蓝色。
【实验验证】检查装置气密性后,装入餐具碎片,按图连接各仪器(夹持装置已略去),开始实验……

【解释与结论】(1)装置A中发生反应的化学方程式为 。
(2)根据 的现象,可证明这种餐具中含有氢元素和碳元素。
(3)实验过程中通 的作用是 。
(4)测得装置C中餐具碎片的起始质量为0.72g,反应后装置C中硬质玻璃管内无固体残留。装置D增重0.36g,装置E和F一共增重1.32g。经计算确认猜想 成立。
【评价与改进】小组内有同学指出餐具碎片可能未完全燃烧,产物为 、 、 的混合物,从而影响对其组成元素的测定,建议 。