国家标准规定工业纯碱中碳酸钠的质量分数≥98.0%为合格品。为测定某工业纯碱是否为合格品,兴趣小组成员分别进行了如图的实验。(杂质不参与反应,过滤后滤渣损失忽略不计)

(1)溶解时玻璃棒的作用是 。
(2)实验中加入过量CaCl2溶液的目的是 。
(3)通过计算判断该工业纯碱是否为合格品。(写出计算过程,结果精确到0.1%)
(4)实验过程中个别同学出现了以下问题。
①过滤时得到的滤液浑浊,原因可能是 ;(任写一种)
②过滤所得的滤渣未经洗涤直接干燥,这一操作会导致该样品中碳酸钠的质量分数计算结果 。(选填“偏大”、“不变”或“偏小”)
以某菱镁矿石(主要成分是MgCO3,含少量MnCO3、SiO2)制取MgSO4•7H2O,流程如图:

(1)“酸浸”时,为了提高浸取率,除了搅拌、提高硫酸浓度外,还可采取的措施有
(写出一种)。此时,MnCO3发生反应的化学方程式是 。
(2)“转化”时主要反应是NaClO+MnSO4+H2O═MnO2↓+NaCl+H2SO4,氯元素反应前后化合价变化情况是 (填“升高”或“降低”)。
(3)硫酸镁溶液在不同温度下进行浓缩结晶,可得到不同的晶体:
温度/℃ |
﹣3.9~1.8 |
1.8~48.1 |
48.1~67.5 |
67.5~200 |
析出晶体 |
MgSO4•12H2O |
MgSO4•7H2O |
MgSO4•6H2O |
MgSO4•H2O等 |
①“操作1”的具体操作是:蒸发浓缩滤液至表面有晶膜出现(此时MgSO4溶液已饱和)、 、过滤、洗涤、低温干燥。
②“操作1”所得滤液中能分离出一种可循环使用的物质,该物质是 H2SO4 (填化学式)。循环使用的目的是 。
(4)已知:MgSO4•7H2O中镁元素质量分数为9.76%。采用热分析法测定所得MgSO4•7H2O样品中镁元素质量分数:
①未加热前,测得样品中镁元素质量分数略大于9.76%,可能的原因是 。
②高于900℃后,测得剩余固体中镁元素质量分数大于20%,可能的原因是 。
(5)若用100t菱镁矿石可制得246t MgSO4•7H2O产品,忽略反应过程中镁元素损失,求该菱镁矿石中MgCO3的质量分数。(写出计算过程)
某同学用溶质质量分数为15%的稀盐酸和大理石反应来制取二氧化碳气体:
(1)用20.3g溶质质量分数为37%的浓盐酸能配制上述稀盐酸 g(结果精确到1g)。
(2)若需收集10瓶(每瓶以125mL计算)二氧化碳气体,同至少需要多少克上述稀盐酸与足量的大理石反应才能制得(实验条件下二氧化碳的密度为2g/L)?(写出计算过程,结果精确到0.01g)
向一定量的H2SO4和CuSO4的混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图所示。
(1)当加入NaOH溶液质量为ag时,溶液中含有的溶质为 。
(2)原混合溶液中,溶质H2SO4的质量(写出计算过程,下同)
(3)恰好完全反应时,消耗NaOH溶液的总质量。

在实验室中做硫在氧气中燃烧的实验,会生成有毒的SO2气体。
(1)为防止造成污染,进行实验时,可在集气瓶里预先放少量的 吸收SO2。
(2)0.5g硫粉在氧气中完全燃烧,理论上可生成SO2的质量是多少?(请利用化学方程式计算)
某工厂废水经初步处理后可得CuSO4和H2SO4的混合溶液,华雪同学设计实验模拟后续处理过程,并得到了Cu和另一种重要化工原料绿矾(FeSO4•7H2O)。其过程如图:

(1)参加反应的CuO质量为 g。
(2)若原混合溶液质量为200g,求混合溶液中H2SO4的质量分数(写出计算过程)。
(3)若反应消耗11.2g Fe,求理论上可得到绿矾的质量(写出计算过程)。
取溶质质量分数为5%的过氧化氢溶液60.0g于锥形瓶中,加入一定量的二氧化锰,反应完全(假定过氧化氢全部分解,产生的氧气全部逸出,水的蒸发忽略不计)。请分析并计算:
(1)上述过氧化氢溶液完全反应后,产生氧气的质量是多少?(写出详细的计算过程,保留小数点后一位)
(2)若测得上述反应后锥形瓶内物质的质量为59.8g,根据二氧化锰在该反应中所起的作用,可知加入二氧化锰的质量应为 g。
将木炭与氧化铜的粉末均匀混合,放入试管中高温加热至质量不再变化,冷却后粉末质量为16.8克。把该粉末全部倒入烧杯中,加入足量的稀硫酸搅拌,得到蓝色溶液和红色不溶物,经过滤、洗涤、干燥,所得红色不溶物的质量为12.8克。固体物质与所加稀硫酸之间的关系如图所示,则:

(1)反应生成铜的质量是 克;
(2)所加稀硫酸的溶质质量分数是 ;
(3)加热前氧化铜的质量是多少克?(写出计算过程)
某化学兴趣小组的同学为测定假黄金(铜锌合金)中锌的质量,取20克假黄金置于烧杯中,取120克稀盐酸,分6次加入,充分反应,实验数据如下:
实验次序 |
1 |
2 |
3 |
4 |
5 |
6 |
加入稀盐酸的质量/g |
20 |
20 |
20 |
20 |
20 |
20 |
剩余固体的质量/g |
18.7 |
17.4 |
m |
14.8 |
13.5 |
13.5 |
请回答:
(1)表中m= 。
(2)假黄金(铜锌合金)中锌的质量是 g。
(3)所用稀盐酸中溶质的质量分数是多少?(写出计算过程)
实验室需要1.2g氧气,若用加热分解高锰酸钾的方法制取这些氧气,消耗高锰酸钾的质量是多少?(计算结果精确至0.1)
小华同学为测定某稀盐酸中溶质的质量分数,在烧杯里放入一定质量的大理石,然后分次加入该稀盐酸,充分反应后测得生成二氧化碳的质量如下表所示(大理石中的杂质不参与反应)。
加盐酸的次数 |
第一次 |
第二次 |
加盐酸的质量/g |
25 |
25 |
生成二氧化碳的质量/g |
2.2 |
1.1 |
(1)两次加稀盐酸后,生成二氧化碳的总质量是 g。
(2)该稀盐酸中溶质的质量分数。
曼曼称取55g氯酸钾和二氧化锰的混合物加热制取氧气,待固体质量不再改变后,她将剩余固体加入到119.2g水中,充分搅拌后过滤,得到滤渣和一不饱和溶液,再将滤渣洗涤干燥后称得其质量为6g。请计算所得溶液中溶质的质量分数。
某兴趣小组利用氯酸钾和二氧化锰制取氧气并回收剩余固体,实验过程表示如图
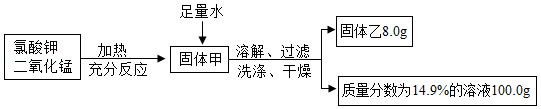
(1)上述制取氧气的反应属于 (填基本反应类型)。
(2)计算所用氯酸钾、二氧化锰混合物的总质量。
将适量的二氧化碳通入到一定质量的氢氧化的溶液中,恰好完全反应,得到106g质量分数为10%的碳酸钠溶液。
(1)反应生成的碳酸钠质量为 g;
(2)反应前氢氧化钠溶液的溶质质量分数(写出计算过程,最终结果保留0.1%)。