氢氧化钠潮解后极易与二氧化碳反应而变质.为测定实验室里一瓶放置已久的烧碱中氢氧化钠的质量分数,某同学取 烧碱样品放在小烧杯中,然后加入 稀硫酸,恰好完全反应,反应后所得溶液的质量为 .计算该烧碱样品中氢氧化钠的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。
(1)配制200g质量分数为8%的氢氧化钠溶液。
①计算:需要氢氧化钠固体的质量为 ▲ g,水的体积为 ▲ mL(水的密度近似看作1g/cm3)。
②称量:调节托盘天平平衡,将一个烧杯放在托盘天平的 ▲ 盘,称量其质量。然后 ▲ (按操作的先后顺序选填字母),直至天平平衡。
A.将氢氧化钠固体加入烧杯中 B.按需要添加砝码、移动游码
该步骤中用烧杯而不用纸称量氢氧化钠的原因是 ▲ .
③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温。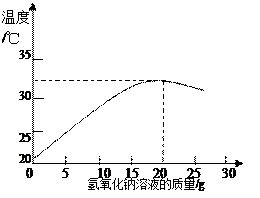
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签。
(2)右图表示用上述配制的氢氧化钠溶液与20 g某稀盐酸发生反应后溶液温度的变化情况。
①根据曲线判断,当加入氢氧化钠溶液的质量为 ▲ 时,反应恰好完全进行。
②当加入15 g氢氧化钠溶液时,所得溶液中的溶质为 ▲ (写化学式)。
③试计算该稀盐酸中溶质的质量分数(请写出计算过程) ▲
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
| |
加入稀硫酸的质量(g) |
充分反应后剩余固体的质量(g) |
| 第1次 |
20 |
17.4 |
| 第2次 |
20 |
14.8 |
| 第3次 |
20 |
12.2 |
| 第4次 |
20 |
12.0 |
| 第5次 |
20 |
m |
试回答下列问题:
(1)上述表格中m的值为 70 ;
(2)黄铜样品中锌的质量分数为 71 ;
(3)所用稀硫酸中硫酸的质量分数是多少? 72
某化学活动小组用稀盐酸对赤铁矿Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液。为防止直接排放造成环境污染,对其组成进一步进行探究。过滤该残液,取100 g滤液,向其中不断加入5%和氢氧化钠溶液,所得实验数据如下表:
| 加入氢氧化钠的溶液的质量/g |
20 |
40 |
60 |
80 |
160 |
180 |
| 生成沉淀的质量/g |
0 |
0 |
0.80 |
1.78 |
5.35 |
5.35 |
(1)通过对上述实验数据的分析,该滤液中含有的溶质是_______(写化学式)。
(2)选择合理的数据,计算100 g滤液中溶质的质量(若有多种溶质,任选一种。结果精确到0.01g)。
淡水资源贫乏已成为全球性的难题,节约用水是每一公民应遵守的公德。日常生活经常会看到厨房中的水龙头滴水、跑水、漏水等问题。请学生们做一道化学计算题:如果一个水龙头按每秒钟滴2滴水,平均每20滴水为1毫升来计算,一昼夜将流失的水为多少千克?(提示:水的密度为“1克/毫升”)
黄曲霉素AFTB(化学式为Cl7H12O6)是大量存在于霉变的大米、花生中,人类的特殊基因在黄曲霉素的作用下会发生突变,继而转化为肝癌。
(1)黄曲霉素由 种元素组成,其分子式共有 个原子,其相对分子质量为 ;
(2)黄曲霉素分子中氧元素的质量分数为 (精确到0.1%)
实验室有一瓶存放时间过长的氢氧化钠,其中一部分已转化成为了碳酸钠。现
需用该药品配制氢氧化钠溶液。取50克该药品,溶于200mL水中(水的密度为1g/cm3),然后慢慢地滴加7.4%的澄清石灰水,当用去100克澄清石灰水时,碳酸钠恰好反应完全。
计算:(1)50克该药品中碳酸钠的质量;(2)滤出沉淀后所得溶液的溶质质量分数。(精确到0.01%)]
实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,设计了实验,实验过程如下:
实验一:取少量样品于试管中,滴加适量稀盐酸,观察到有气泡产生,说明氢氧化钠已变质,变质的原因是___________________________(用化学方程式表示)。
实验二:
通过实验二,能进一步推算出氢氧化钠变质的程度。请计算实验二中参加反应的碳酸钠质量。(化学方程式:Na2CO3+ CaC12=CaCO3↓+2NaCl)
结论:16.0 g干燥的样品中已变质的氢氧化钠的质量是 g。
(5分)甲、乙、丙三位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0 g样品溶于一定量的水中得到25.0g溶液,再分别加入不同质量,溶质质量分数为10%的氢氧化钠溶液,反应得到沉淀的实验数据如下表:
| |
甲 |
乙 |
丙 |
| 加入氢氧化钠溶液质量 (g) |
35.0 |
40.0 |
45.0 |
| 反应得到沉淀的质量 (g) |
2.5 |
2.9 |
2.9 |
试回答下列问题:
(1)上述实验中,__ __同学所用的氢氧化钠溶液一定过量。
(2)求样品中氯化镁的含量(写出计算过程,结果精确到0.1%,下同)。
(3)计算乙同学实验后所得溶液中的氯化钠的质量分数。
现称取变质的氢氧化钠样品10g,配制成溶液,再向其中加入CaCl2溶液(反应的化学方程式为:Na2CO3+CaC l2 = CaCO3↓+2NaCl)。反应时CaCl2溶液与沉淀的质量关系如图所示。请解决以下问题:
l2 = CaCO3↓+2NaCl)。反应时CaCl2溶液与沉淀的质量关系如图所示。请解决以下问题:
(1)计算样品中NaOH的质量;
(2)计算所加CaCl2溶液的溶质质量分数;
(3)恰好完全反应时烧杯中溶液的pH______7(选填“>”、“<”或“=”)
现将71.9g高锰酸钾与二氧化锰的混合物充分加热,冷却后称得剩余固体的质量为65.5g。
请计算:
(1)生成氧气多少克?
(2)反应后剩余固体中钾、锰两种元素的质量比
根据图示情景和范例,编写计算题,并完成相关内容。
【情景1】要配制一定质量分数、一定质量的氯化钾溶液,应该怎么操作?
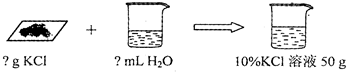
(1)编题范例 配制10%的氯化钾溶液50g,分别需氯化钾固体和水各多少?
(2)配制该溶液的操作步骤
①计算:②称量:用托盘天平称取所需固体,再用mL的量筒量取所需的水;
③溶解:将称得的氯化钾固体放入烧杯中,再倒入量取的水,用玻璃棒充分搅拌;
④装瓶:将配制的溶液倒入试剂瓶,并贴上标签。
【情景2】已知一定质量分数、一定质量的氢氧化钾溶液与一定质量的盐酸反应,得到只有一种溶质的溶液,求算反应后溶液的溶质质量分数。

(1)编写题目(2)计算过程.