氢氧化钴[Co(OH)2]受热易分解,能与酸性溶液反应,可作涂料和清漆的干燥剂,制备方法为:①Co+2HCl=CoCl2+H2↑,②CoCl2+2NaOH=Co(OH)2↓+2NaCl。下列判断正确的是
| A.钴的金属活动性比铜的弱 | B.①为置换反应,②为复分解反应 |
| C.氢氧化钴的化学性质稳定 | D.氢氧化钴可以干燥氯化氢气体 |
阅读下面科普短文。
肼(N2H4)又称联氨,有类似于氨的刺鼻气味,贮存时用氮气保护并密封,用途广泛。肼燃烧放热量大且燃烧产物对环境无污染,常用作火箭燃料,点燃时与助燃物质液态N2O4发生反应,生成N2和H2O。高压锅炉水处理时用于脱除氧气以防止锅炉的腐蚀,也可以把锅炉内表面锈蚀后的氧化铁还原为结构紧密的四氧化三铁保护层,减缓锅炉锈蚀。用于烟草、土豆、玉米的贮藏,用于食用盐酸的制造等。熔点1.4℃,沸点113.5℃;有强烈的吸水性,形成水合肼(N2H4·H2O),可以用固体烧碱进行脱水;能吸收空气中的二氧化碳;易溶于水;与液氧接触能自燃;长期暴露在空气中或短时间受热时易发生分解。对眼睛有刺激作用,能引起延迟性发炎,对皮肤和粘膜也有强烈的腐蚀作用。
依据短文内容,回答下列问题:
(1)肼的下列性质中,属于化学性质的是 (填字母序号,下同)。
A.与氧化铁作用 B.易溶于水
C.易分解 D.有刺鼻的气味
(2)肼在常温下为______(填“固态”“液态”或“气态”)。
(3)肼作为火箭燃料燃烧时反应的化学方程式为 。
(4)肼有强烈的吸水性,能吸收空气中的CO2,下列物质中的 也具有这些性质。
A.NaCl B.Ca(OH)2 C.NaOH D.NaHCO3
(5)肼需要密封保存的原因是______。
对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越强.常温下,20%的稀硫酸的pH (填“大于”“小于”或“等于”)10%的稀硫酸的pH。如果要使10%的稀硫酸的pH升高,可采取如下方法:
(1)发生化学反应的方法:可以加入的物质是(要求物质的类别不同) 、 。
(2)通常类别相同的物质具有相似的化学物质,稀盐酸、稀硫酸有许多相似的化学性质,是因为_____。
(3)【查阅资料】资料一:已知复分解反应CaCO3 +2HC1= CO2↑+ H2O + CaCl2可自发进行。在常温下,测得浓度均为a%的下列六种溶液的pH大小情况:
表中pH大小情况揭示出复分解反应的一条规律,即较强酸发生类似反应可以生成较弱酸。下列反应均能发生,其中不符合该规律的是(填字母)_______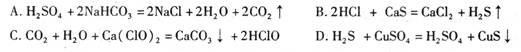
为研究草酸亚铁晶体(FeC2O4·2H2O,相对分子质量是180)分解的产物,在实验室里称取一定量的草酸亚铁晶体,利用下列装置进行实验。
①实验过程中观察到B中白色无水CuSO4变色蓝色,C、F中澄清石灰水变浑浊;则E中现象是____(填实验现象)。分解产物中有CO气体,还有______________。
②若该实验过程中E装置内有6.4g铜生成,计算有多少物质的量的氧化铜参加了反应?(写出反应的化学方程式,列出计算步骤!)____________
写出方程式:____________
计算步骤:____________
③为验证CO的性质,收集装置D后的气体于集气瓶中,将点燃的木条伸入集气瓶中(如下图),在此过程中的实验现象是_____________(选填编号)。
A.木条熄灭 B.木条继续燃烧
C.瓶口产生淡蓝色火苗 D.发生爆炸
④进行上述实验时,先点燃A处的酒精灯,一段时间后再点燃E处的酒精灯,原因是____________。
⑤若通过F装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解的气体产生物中有CO,则需在C和D装置之间增加如下图所示的洗气瓶:
其中氢氧化钠溶液中发生的反应方程式是:___________________________;
澄清石灰水起到的作用是:___________________________________________________。
活性氧化锌(ZnO) 是一种面向21世纪的新型高功能精细无机产品。用粗ZnO制备活性ZnO的生产工艺流程做如下图所示。
I制备活性氧化锌
一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下: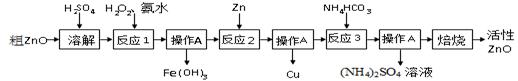
【查阅资料】
1、粗ZnO中常含杂质FeO、CuO
2、反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
3、已知:几种物质沉淀时的pH如下表:
| 物质 |
Fe(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
Cu(OH)2 |
| 开始沉淀时pH |
6.34 |
1.48 |
6.2 |
5.2 |
| 完全沉淀时pH |
9.7 |
3.2 |
8.0 |
6.4 |
| Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去。 |
【问题讨论】
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是___________ __________ _ 。
(2)写出ZnO与加稀硫酸反应的化学方程式 。
(3)反应1的目的将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3 ,为了暂不形成Cu(OH)2、Zn(OH)2 ,该步骤需控制溶液pH的范围是 ,操作A的名称是 。
(4)反应2中加入锌发生的反应属于 反应(填化学反应的基本类型)。
Ⅱ测定碱式碳酸锌的化学式
碱式碳酸锌的化学式是xZnCO3•yZn(OH)2•zH2O,用下列装置测定碱式碳酸锌的化学组成。(假设每步反应、吸收均完全)
提示:碱式碳酸锌xZnCO3•yZn(OH)2•zH2O受热分解为ZnO、H2O、CO2三种产物,其中
ZnCO3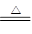 ZnO+CO2↑ Zn(OH)2
ZnO+CO2↑ Zn(OH)2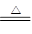 ZnO+H2O
ZnO+H2O
【实验步骤】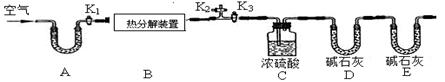
①按图连接好装置,并检查装置的 ;
②在热分解装置中装入68.2g样品,打开活塞 ,关闭 ,缓缓鼓入空气数分钟;
③称量装置C、D的质量;
④关闭活塞K1,K2,打开K3,启动热分解装置,使样品充分热解;
⑤停止加热,继续通空气至装置冷却到室温; ⑥再次分别称量装置C、D的质量.
【记录数据】该小组同学按上述实验步骤进行实验,并记录了如下数据:
| |
装置C的质量(/g) |
装置D的质量(/g) |
| 实验前 |
198.4 |
235.7 |
| 实验后 |
209.2 |
244.5 |
【实验分析及数据处理】
(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是 。
(2)第⑤步继续通空气的目的是 。
(3)E处碱石灰的作用是 ,若没有此装置,测得二氧化碳的质量 (填“偏大”、“偏小”或“无影响”)。
(4)根据上述数据,计算xZnCO3•yZn(OH)2•zH2O中x:y:z的最简比=
该碱式碳酸锌受热分解的化学方程式为 。
一辆有约30吨硝酸的罐车在某厂道路发生侧翻,硝酸泄露,散发出黄色烟雾,流到石灰石地面,发出嘶嘶声,产生大量气泡,泄露出来的硝酸不断流进路边的排水沟,气味十分刺鼻.
(1)由题给信息可知,硝酸的物理性质是 _________ (任写一条)
(2)硝酸见光后,除分解生成二氧化氮气体外,还生成水及占空气体积分数约21%的气体,实验室保存硝酸应密封,遮光保存在棕色瓶内,放在低温阴凉处,硝酸见光分解的化学方程式为 _________
(3)为消除硝酸对环境的污染,对泄露的酸必须处理,经济上合理、对环境污染小的化学处理方法是 ________ .
硝酸可发生反应:
。据此回答:
(1)反应的基本类型属于反应。
(2)
的化学式为,推断的依据为。
(3)硝酸的保存应注意、。