(3分)高纯度的氧化铜可用作颜料、有机合成催化剂等,以下是用粗铜氧化法获取高纯度氧化铜的流程图。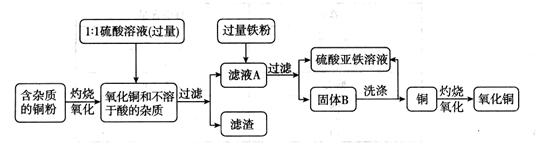
回答下列问题:
(1)写出硫酸与氧化铜反应的化学方程式:________________________________。
(2)写出固体B所含的物质:_________。
(3) 洗涤固体B应使用的试剂是______________。
某电镀厂排放的污水中含有CuSO4、ZnSO4、FeSO4,为减少水污染及节约成本,回收重要物质硫酸锌及有关金属,设计如下所示流程。
该回收流程中:固体A的成分是 ;含铁元素的物质(污水除外)有 (填字母序号),试写出滤液C与适量的甲发生的化学反应方程式 。
下列除杂的实验过程都正确的是(括号内为杂质)
| A.KCl(K2CO3) 加适量稀盐酸,蒸发 |
| B.CO2(CO) 点燃 |
| C.NaCl(CuSO4) 溶解,加适量Ba(OH)2溶液,过滤、蒸发 |
| D.MnO2(KCl) 加水溶解、过滤、蒸发 |
某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示。
回答下列问题:
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是 。
(2)工厂废液中加入过量A反应的化学方程式为 。
(3)固体乙的主要成分是 。
(4)铁红是炼铁的主要原料,用CO和铁红炼铁的化学方程式为 。
(5)某研究性学习小组的同学为了测定某钢铁厂生铁样品中铁的质量分数,在实验室中
称取生铁样品5.8g放入烧杯中,然后再加入足量的稀硫酸,使之充分反应后,共收
集到0.2g氢气(杂质不参加反应)。则该生铁样品中铁的质量分数为 。(列出计算过程,保留一位小数。)
如图,A、B、C、D、E是初中常见的五种物质,其中气体A与C组成元素相同,B和E是红色固体,D为黑色粉末。(部分生成物未标出)
(1)写出下列物质的化学式:E__________。
(2)写出反应①的化学方程式______________________________。
(3)反应③的基本反应类型是__________反应。
A-J是初中化学常见的物质,它们之间的转化如图1所示("-"表示相邻的两物质可以发生反应,"→"表示箭头前面的物质可以转化为箭头后面的物质;部分反应的反应物、生成物和反应条件没有标出)。图2所示的是部分物质的相关信息;I、J中含有相同的金属元素,H的相对分子质量比E的大。
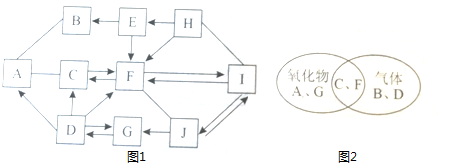
(1)F的化学式是。
(2)物质I俗称。
(3)写出上述物质转化过程中属于分解反应的一个化学方程式。
(4)写出H→E的化学方程式。
A~G均为初中常见的化学物质(“→”表示物质 间的转化关系,“—”表示两端的物质能发生化学反应),其中A、F是初中阶段常见的两种氧化物;B、D是初中阶段常见的两种碱; G是一种常见的建筑材料,E是人体胃液中的一种酸,它们之间有如下图的相互转化关系(图中部分生成物已略去)。请回答下列问题:
(1)B物质的俗称是_ ,
(2)C的化学式为__ 。
(3)写出化学反应①和②的化学方程式:
①__ ____;②____ _______。
甲、乙、丙三种物质之间的转化关系如右图,已知甲是常见的气体单质,乙、丙都只含两种元素,且组成元素相同。
回答下列问题:
(1)甲的名称是_ __,丙的化学式 ,甲的一种用途是 。
(2)写出“丙→甲”反应文字表达式 _,从微观角度看,该反应中没有改变的微粒是__ _ (填符号)。
已知A、B、C、D、E为初中化学中常见的五种不同类别的物质,其中A为年产量最高的金属单质,各种物质间的反应和转化关系如图所示(“——”表示相连的两种物质之间可以发生反应,“―→”表示一种物质可以转化为另一种物质;反应条件、部分反应物和生成物已略去)。请写出:
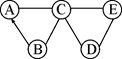
(1)B的化学式:_____________________;
(2)D与E反应的化学方程式:_ __。
除去以下物质中的少量杂质,所用试剂及方法正确的是
| 选项 |
物质 |
杂质 |
所用试剂及方法 |
| A |
|
通入足量的
溶液 |
|
| B |
溶液 |
稀盐酸 |
加入过量的
,过滤 |
| C |
溶液 |
溶液 |
加入足量的
粉,过滤 |
| D |
溶液 |
溶液 |
加入适量的
溶液,过滤 |
甲、乙、丙、丁都是初中化学中最常见的物质,已知它们由
、
、
、
、
、
6种元素中的2种或3种组成,丙与甲、乙、丁都能发生反应。将这四种物质的溶液按下图所示相互滴加,现象为:①产生白色沉淀;②有气泡冒出;③无明显现象。
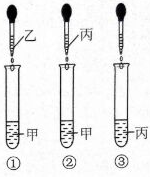
(1)甲、乙、丙、丁都属于(填"单质"或""化合物")。
(2)试管②中产生的气体是(填化学式)。
(3)试管①中反应的化学方程式是。
(4)向试管③滴加的溶液溶质可能是(填化学式,下同)或。
FeCl3可用作催化剂和外伤止血剂.某实验兴趣小组利用FeCl3腐蚀电路铜板后的溶液(主要成分为FeCl2、CuCl2)进行了氯化铁回收实验。
该实验小组同学通过查阅资料,进行了尝试。
【阅读资料:】
不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离。右表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
| |
Fe(OH)3 |
Cu(OH)2 |
| 开始沉淀的pH |
1.9 |
4.7 |
| 沉淀完全的pH |
3.2 |
6.7 |
(1)进行操作x时,应用到的仪器有:铁架台、玻璃棒、烧杯和 。
(2)实验中,步骤b加入CuO消耗溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式 ;你认为步骤b调节溶液的pH到 (填数值范围)比较合适。
(3)实验中,步骤d加稀盐酸前,因缺少 (填操作名称)而使获得的氯化铁溶液不纯。
(4)FeCl3溶液容易生成Fe(OH)3发生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用 (用字母表示)最合理。
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.
甲、乙、丙、X是初中化学常见的物质,分别属于单质、氧化物、酸、碱、盐中的不同类别,且各物质之间的关系如下图所示(图中“ ”表示相连的物质间可以发生反应,“ ”表示物质间存在转化关系)。
”表示物质间存在转化关系)。
已知X是植物光合作用的气体原料,丙为黑色固体。
(1)X的名称为 ;丙物质的化学式为 。
(2)若甲与X的组成中不含相同的元素,且甲能与乙发生反应,该反应的化学方程式为 。
(9分)老师在指导学生记忆化学方程式时指出很多反应可以归纳,如:氧化钙、氢氧化钙、碳酸钙等与盐酸反应时生成物中都含有氯化钙和水。同学们兴趣很高,也进行了归纳:
(1)甲物质与稀硫酸反应时生成物中有CuSO4和H2O,则甲物质可以是 和
(请填写两种不同类别物质的化学式);写出上述转化过程中,属于中和反应的化学方程式
。
(2)A﹣H都是初中常见的物质,其中D为蓝色沉淀,A、E是组成元素相同的两种气体,F、H为黑色固体。他们之间转化关系如下图(反应条件及部分反应物和生成物已略去)
①C的化学式是 ;
②写出反应写出反应A E的化学方程式 ;
E的化学方程式 ;
③写出反应E→G的化学方程式 。
下列除去物质中的少量杂质(括号内为杂质)的方法,正确的是()
| A. | ( )--通过足量的灼热氧化铜 |
| B. | 粉末( )--溶解、过滤、洗涤、干燥 |
| C. | 溶液( )--加入足量锌粉、过滤 |
| D. | 溶液( )--加入适量硝酸银溶液、过滤 |