有A、B、C、D、E五种物质,在常温下A、B、C是气体,D是淡黄色色固体,E是液体,五种物质中只有C有刺激性气味;其中C和D内含同一种元素;B和E内含有同一种元素,A、C、E内含有同一种元素。五种物质间的化学反应的转变关系如下图:
①E A + B ②A + D
A + B ②A + D 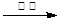 C
C
根据以上叙述回答问题:
(1)写出下列物质的名称:A ;C 。
(2)写出上述②反应的化学方程式,并注明基本反应类型。
② ( )反应
下表是元素周期表中1~18号元素原子核外电子排布,我对它进行研究: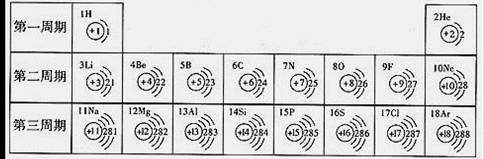
(1)第12号元素它属于 32 元素(填“金属”或“非金属”),它在化学反应中容易 33电子,它的离子符号为 34 。
(2)从上表中我探究出以下规律:在原子里,核电荷数=原子序数= 35 。
(3)我通过细致地分析,还可以总结出一些规律: 36 。
、
、
、
、
、
都是初中化学中常见的物质。它们的转化关系是:

请回答下列问题:
(1)检验集气瓶内气体甲的操作方法是。
(2)在反应②③中,固体
起作用。
(3)写出反应①和④的化学方程式:
①;④。
(4)溶液
的溶质是。
以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为"氯碱工业",它是目前化学工业的重要支柱之一。由于粗盐中含有少量
、
、
等杂质,不符合电解要求,因此必须经过精制。以粗盐为原料的"氯碱工业"流程如下:

回答下列问题:
(1)氯气、氢氧化钠在工业上有广泛的用途。下列关于氢氧化钠的描述中,错误的是。
| A. | 能去除油污,可做厨房清洁剂 | B. | 易溶于水,溶解时放出大量的热 |
| C. | 水溶液能使石蕊溶液变红 | D. | 可用作某些气体的干燥剂 |
(2)操作②的名称是,操作④的名称是。
(3)操作①②间除杂质时所加的三种试剂是
溶液、
溶液、
溶液(均过量),其顺序要求是:
溶液必须在
溶液之(填"前"或"后")加入。有同学提出用溶液代替
溶液可达到同样的目的。
(4)电解饱和
溶液的化学方程式是。
(5)该流程中可以循环利用的物质是。
一包白色粉末,由
、
、
、
、
中的两种或两种以上的物质混合而成。为探究其组成,进行如下实验:
(1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液。则原白色粉末中一定不含有。
(2)取实验(1)滤出的白以沉淀,向其中加入足量的盐酸,沉淀全部溶解,并产生无色气体。则原白色粉末中一定含有。根据上述实验可推断:原白色粉末的组成有种可能。为进一步探究原白色粉末的组成,取实验(1)得到的滤液,向其中通入二氧化碳,产生白色沉淀,则可推断原白色粉末中一定还含有。
现有 、 、 、 四种元素, 元素的单质是同条件下最轻的气体, 元素的原子核外有两个电子层,第二层上有6个电子, 元素能形成多种单质,其中一种单质是天然存在的最硬的物质,青少年缺乏 元素会得佝偻病。 元素的单质是,它是由(填"分子"或"原子")构成的; 、 、 三种元素的名称或符号是: 、 、 ; 、 二种元素组成的化合物的化学式是。
已知:①金属钠是一种活泼的金属,与水反应生成氧氧化钠和氢气;②难溶于水的碱受热分解生成相应的氧化物和水。A、B、C、D、E、F、G、H是初中化学中常见的物质,甲、乙、丙是三种金属。其中甲最活泼,乙是红色金属,丙能被磁铁吸引。各物质间相互转化关系如下图:
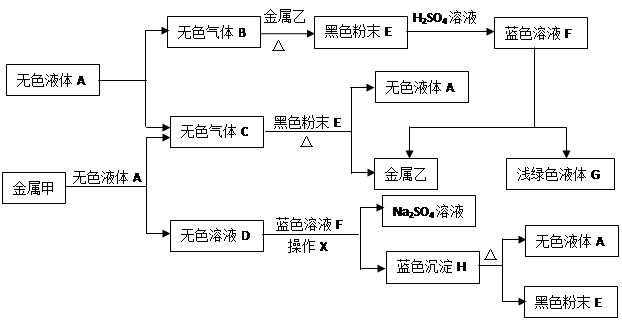
请回答下列问题:
(1)写出A、E、G的化学式:A ,E,G。
(2)操作X的名称是。
(3)①无色溶液D与蓝色溶液F反应的化学方程式为;
②金属甲与无色液体A反应的化学方程式为,该反应的基本类型;
③蓝色沉淀H受热分解反应的化学方程式为。
(4)甲、乙、丙三种金属的活动性由强到弱的顺序是,无色气体C在点燃或加热前必须进行的操作是。
金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于变化。钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择(选填"铜块"、"锌块"、"铅块")。
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为。
②实验室常采用操作进行沉淀分离。
③生产高纯碳酸钙时,选择"220℃恒温干燥"而不选择"灼烧"的原因是。
④高纯氧化钙生产过程中,"干燥"的主要目的是为了防止(用化学方程式表示)。
(3)有机高分子材料"玉米塑料",因其可降解被广泛用来替代一次性泡沫塑料,"玉米塑料"的使用可减少污染。20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用方法区分尼龙和蚕丝。
(7分)下图是对生成氯化钠反应关系的归纳与整理。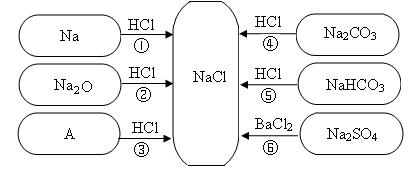
请回答下列问题:
(1)物质A是常见的碱,写出A的化学式:______。
(2)写出反应①的化学方程式:___________________。
(3)说出NaHC03在医疗上的一种用途:______________ 。
(4)反应③、④、⑤、⑥能够进行的原因是_______________。
(5)实验室配制200g 8%的NaCl溶液,需要水的质量是___________g,配制过程中为了加快NaCl的溶解,可以采取的措施是_____________。
A、B、C、D、E、F、G是初中化学常见的物质,A在常温下是一种无色液体,D是天然气的主要成分,G是一种重要建筑材料的主要成分,E是一种金属氧化物,与A反应能生成一种常见的碱。它们之间的转换关系如下图所示:

(1)写出下列物质的化学式:A_、D。
(2)写出反应④的化学方程式。
(3)E在日常生活中用途广泛请写出其中一点。
(4)点燃B、D之前一定要。
(5)B是最清洁的燃料,与其它燃料相比其优点有,但是作为燃料暂时还不能广泛使用你认为的原因是:。
氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。某工厂以石灰石为原料生产二水化钙(
)的流程如下。原料石灰石中含有杂质主要是
。
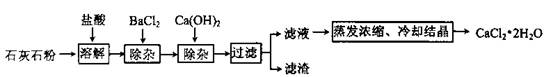
(1)石灰石粉溶解时,
发生反应的化学方程式为。
(2)加入
除去的杂质离子是;加入
除去的杂质离子是。
(3)检验"滤液"酸碱性,如果显碱性,还需加入适量的(填化学式)提高产品纯度。
现有一包固体粉末,可能由
、
、
中的一种或几种组成。为确定其组成,进行了如下图所示的实验(假设实验过程无损耗)。

请回答:
(1)根据实验可以确定白色沉淀是 ;原固体粉末中一定含有,它的可能组成有种。
(2)若实验取固体粉末20
,生成白色沉淀10
,最后得到溶质质量分数为5.85%的
溶液200
(只含一种溶质),则
溶液中溶质的质量是
,固体粉末由(填化学式,下同)组成,其中质量小于10
的是。
硝酸可发生反应:
。据此回答:
(1)反应的基本类型属于反应。
(2)
的化学式为,推断的依据为。
(3)硝酸的保存应注意、。
氯化钙是多用途的干燥剂和建筑防冻剂。实验室里用石灰石和盐酸制备二氧化碳的含酸废液(含有MgCl2、FeCl3等)通过以下途径制得无水氯化钙。
(1)操作I的名称为 ,操作II的名称为 。滤渣 的化学成分有
的化学成分有
。
(2)石灰乳的作用是① ,② ,写出其中1个反应的化学方程式 。
孔雀石主要含Cu2(OH)2CO3〔也可认为是Cu(OH)2·CuCO3〕,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O,步骤如下:
请回答下列问题:
(1)气体E的化学式是 。
(2)由溶液C获得CuSO4·5H2O,需要经过蒸发浓缩、冷却结晶、 和干燥等操作。
(3)写出孔雀石主要成分与稀硫酸反应的化学方程式: 。