碳酸钙、碱石灰(NaOH和CaO的混合物)等作为吸收剂可以对燃煤烟气进行脱硫处理,利用数字化实验可以来测定燃煤烟气中SO2的含量,得到如图所示的SO2含量与时间的关系曲线图
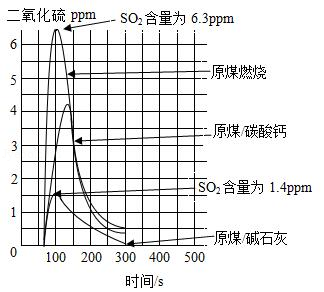
(1)由图可知,脱硫效率较高的吸收剂是 (填名称)。
(2)实验时,称取的3份原煤的质量要相等,其目的是 。
(3)利用碳酸钙吸收SO2转化为CaSO3,CaSO3与空气中O2反应转化为CaSO4.写出CaSO3转化为CaSO4的化学方程式 。
(4)利用碱石灰吸收SO2时,下列措施能使脱硫效率提高的是 (填序号)
a.将原煤与碱石灰粉碎,混合均匀
b.将碱石灰的用量适当增加
c.将时间300s变为500s
(5)利用碱石灰吸收1.28gSO2时,碱石灰中的NaOH、CaO与SO2反应转化为Na2SO3和CaSO3,则理论上反应消耗碱石灰的质量(m)范围是 。
如图装置可用于实验室制取常见的气体
(1)仪器A的名称是 ;气球的作用是 .
(2)制取O2.Y是 ;实验时,气球先变大,后变小.先变大的原因有:①反应生成了气体,气体进入气球;② .
(3)制取CO2.写出有关反应的化学方程式 .
(4)制取H2.现取足量的粗锌加入到25g稀硫酸中,充分反应后,产生0.1g氢气,则所用稀硫酸中溶质的质量分数为多少?(写出计算过程)

同学们利用如图所示的装置,对质量守恒定律进行了探究。实验结束后,老师另外提出了几个问题,请你一起参与思考。
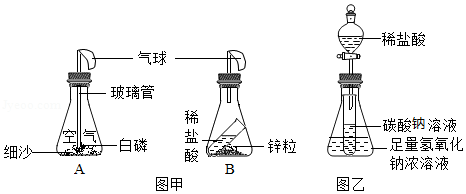
(1)图甲装置内物质充分反应后,冷却至室温,气球仍胀大的是 (选填“A”、“B”或“A和B”)
(2)若图乙装置内Na2CO3溶液的质量为5克,滴入试管的稀盐酸质量也是5克,装置内物质充分反应后,发现NaOH浓溶液质量增加0.22克,试管中滴入紫色石蕊试液变红。根据上述已知条件,通过分析可以确定的是 (选填序号)
①原稀盐酸的溶质质量分数 ②原Na2CO3溶液的溶质质量分数
③原NaOH溶液的溶质质量分数 ④反应后试管中NaCl的溶质质量分数
请你选择所填的其中一项,通过计算确定其溶质质量分数是多少?
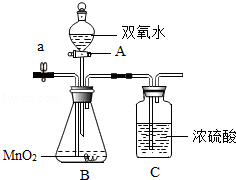
实验室新购买了一批双氧水(H2O2)溶液,某兴趣小组的同学要测定其质量分数,他们设计如图所示的装置,其实验的操作步骤如下:
①组装仪器,并检查装置的气密性;
②在A、B、C三个仪器中装入药品,其中双氧水溶液质量为50g;
③用电子秤称量出整套装置的总质量为498.6g;
④关闭a处止水夹,打开A仪器的阀门,向锥形瓶中加入全部的双氧水溶液,随即关闭A仪器的阀门;
⑤充分反应后,打开a处止水夹,向装置中持续缓慢地鼓入X气体;
⑥第二次称量整套装置的总质量为497g。
(1)本实验采用的装置中,A仪器的名称是
(2)为尽可能减小测量误差,请结合测量原理判断,操作⑤中鼓入的X气体是 。
A.氦气 B.经干燥处理的空气 C.除去氧气后的空气
(3)根据题意,计算双氧水溶液中溶质的质量分数,写出计算过程。
为测定某硫酸中溶质的质量分数,小荣同学取该硫酸样品200g,向其中加入过量的锌粒完全反应后,收集到0.8g氢气,计算这种硫酸中溶质的质量分数。
如图是实验室制取气体的常用装盆,请回答下列问题:

(1)写出图中标号仪器的名称:a 、b .
(2)实验室可加热KMnO 4固体制取O 2:
①请写出该反应的化学方程式 ;
②如A所示,加热一段时间后,某同学发现试管口未放置棉花团,应采取的正确操作: ,再组装好仪器继续实验.
(3)实验室可用锌粒与稀硫酸反应制取H 2,请写出该反应的化学方程式: ,应选用的装置是 (填字母).
(4)实验室选用C装置制取CO 2的化学方程式:CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑
请计算:
①CO 2的相对分子质量是 ;
②现需收集4 瓶(每瓶0.125L) CO 2气体(实验条件下CO 2的密度为2g•L ﹣ 1),其质量是 g;
③收集上述CO 2至少需要大理石(含CaCO 38O%)的质量是 g (精确到0.1g).
根据如图回答问题。

(1)仪器①的名称是 。
(2)实验室用氯酸钾制取氧气的化学方程式为 。所选用的收集装置是E或 (填字母序号,下同)。
(3)实验室用大理石和稀盐酸制取二氧化碳,所选用的发生装置是 。收集一瓶二氧化碳,将燃着的木条放在瓶口,若观察到 ,说明瓶中已充满二氧化碳。
(4)某同学用较浓的盐酸制取氢气,若要制取并收集一瓶较纯净的氢气,则装制连接顺序序号为 。
(5)实验室制取2g氢气,理论上应取锌的质量是 g。
为了测定金属镁样品中镁的质量分数(杂质不含镁元素,不溶于水,也不与其它物质发生反应),进行了如下实验:

请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为 。
(2)根据已知条件列出求解第一次所加的稀盐酸中溶质质量(x)的比例式 。
(3)此镁样品中镁的质量分数为 。
(4)用36.5%的浓盐酸配制200g上述稀盐酸,所需浓盐酸的质量为 。
(5)若将反应后的滤液蒸发104.4 g水,无晶体析出,所得溶液中溶质的质量分数为 。
(6)若要生产含镁4.5%的铝合金960 t,需要上述金属镁样品的质量为 。