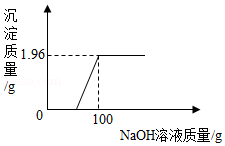
向一定质量的酸性CuSO 4溶液(含少量H 2SO 4)中逐滴加入NaOH溶液,产生沉淀的质量与所加入NaOH溶液的质量关系如图所示。
(1)当加入NaOH溶液的质量为30g时,溶液中的溶质是 (化学式)。
(2)计算所加NaOH溶液的溶质质量分数。

酸奶作为世界公认的长寿食品之一正愈来愈受到人们的重视和喜爱。酸奶中的酸味来自乳酸(化学式为C3H6O3)。
(1)酸奶主要提供人类营养物质中的哪一类? 。乳酸在人体内可被完全氧化为CO2和H2O,1.8 g乳酸完全氧化消耗O2的质量为 g。
(2)为了测定某品牌酸奶中乳酸的含量,振华同学取100 mL酸奶和100 mL蒸馏水于烧杯中,慢慢滴入0.4%的 NaOH溶液并不断搅拌,用传感器测得溶液pH随加入NaOH溶液体积V的变化关系如图所示。计算该酸奶中乳酸的含量为多少克每升。
(已知:乳酸的钠盐可表示为CH3CH(OH)COONa,测定所用NaOH溶液的密度为1.0 g/mL,计算结果精确到0.01,无计算过程不给分)。

某化工厂排放的废水中含有H2SO4和CuSO4两种污染物。为测定废水中两种污染物的含量,给该化工厂提供污水处理的参考,某化学小组进行了以下实验:取该废水100g,向其中加入溶质质量分数为10%的NaOH溶液,测得生成沉淀的质量与加入NaOH溶液的质量关系如图所示,回答下列问题(写出计算过程):
(1)100g废水中含CuSO4的质量为多少?
(2)废水中H2SO4的质量分数为多少?
水与自然界中矿石长期接触,常含Ca(HCO3)2、Mg(HCO3)2等物质,导致钙离子、镁离子含量较多,称之为硬水。生活中,水的硬度过高会造成一定危害。长期使用硬水烧水的热水壶,内部会形成一层水垢,其主要成分为碳酸钙和氢氧化镁,说明加热煮沸可使这类硬水成为软水。其原理的流程如下(气体产物已略去):

回答下列问题:
(1)反应Ⅰ属于四大基本反应类型中的 反应;反应Ⅱ除产生水垢外,还有一种气体产物为 ;如果当地硬水中CaSO4含量较多,则水垢中还常含有少量CaSO4,CaSO4析出的原因是 。
(2)向200g水垢中加入400g过量的稀盐酸,充分反应,测得3分钟内混合物质量的变化(不考虑水与HCl的挥发)如下表所示:
时间/s(秒) |
0 |
30 |
60 |
90 |
120 |
180 |
混合物的质量/g |
600 |
574 |
554 |
547.2 |
547.2 |
547.2 |
①观察到的现象是 。
②计算水垢中碳酸钙的质量分数,写出必要的计算过程。
水污染与防治是当今人类需要关注的环境问题之一,工农业废水和生活污水是水污染的主要来源。回答下列问题:
(1)酸雨 (填“能”或“不能”)污染水体,煤燃烧产生SO2,SO2形成酸雨的主要原因是 。
(2)废旧电池中含有的汞、镉等重金属会污染水体,造成生物体中毒,其原因是重金属能使生物体内的 (填化学物质)结构破坏,失去生理活性。
(3)某工业废水含HgSO4,可通过铁网而将汞留下,加热将汞形成蒸气回收利用。其反应的化学方程式为 ,汞的沸点 (填“低于”或“高于”)铁的沸点。也可以向废水中加入Na2S溶液形成沉淀而除去汞,该沉淀的化学式为 。
(4)甲厂污水含硫酸的质量分数为0.98%,其流速为45kg/s,乙厂污水含烧碱的质量分数为0.4%,为排放达标,现将两厂的污水混合处理,反应的化学方程式为 ,则乙厂污水的最佳流速为 kg/s。
某工厂化验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸(该产品中其它物质不与氢氧化钠反应),消耗氢氧化钠溶液的质量与反应过程中溶液的pH值关系如图所示。
(1)图中A点表示的意义是 。
(2)求这一石油产品中残余硫酸的质量(写出计算过程)。

生铁和钢都是由铁和碳组成的合金,生铁中碳的含量为2%~4.3%,钢中碳的含量为 0.03%~2%,为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品盛放在烧杯中,并向其中逐滴加入稀盐酸至恰好完全反应,实验数据如下表所示:
烧杯质量 |
样品的质量 |
稀盐酸的质量 |
烧杯+剩余物的总质量 |
50g |
5.8g |
94.6g |
150.2g |
注:碳既不溶于水也不与稀盐酸发生反应。
请根据相关信息完成下列计算:
(1)恰好完全反应时,生成氢气的质量为 g;
(2)样品中碳的质量分数 (计算结果保留到0.1%);
(3)反应后得到的溶液中溶质的质量分数(计算结果保留到0.1%)。
某实验小组同学做中和反应实验时,向80g质量分数为10%的氢氧化钠溶液中逐滴加入稀硫酸,当恰好完全反应时,共用去稀硫酸62g。请你计算:
(1)氢氧化钠溶液中溶质的质量为 g。
(2)反应后所得溶液中溶质的质量分数?
某NaCl样品中混有杂质BaCl2,为测定样品中BaCl2的质量分数,取固体样品10.0克完全溶解于水中,并向其中逐滴加入稀硫酸,实验过程中,产生沉淀的质量与加入稀硫酸的质量关系如图所示
(1)沉淀的化学式 。
(2)计算样品中BaCl2的质量分数(写出计算过程)

向54.5g某物质质量分数的盐酸溶液中加入4g氢氧化钠固体恰好完全反应,求所得溶液中溶质的质量分数。
我国化学家侯德榜创立了侯氏制碱法,为世界制碱工业作出了突出贡献。在实际生产的产品碳酸钠中会混有少量的氯化钠,现有该样品混合物20.4g,将其放入一洁净的烧杯中,向其中逐滴滴入7.3%的稀盐酸,放出气体质量与滴加稀盐酸质量的关系如图所示。请回答下列问题:
(1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH 7(填"<"">"或"=");
(2)该样品混合物中碳酸钠的质量 g;
(3)当滴加稀盐酸至图中A点时,烧杯中所得溶液为不饱和溶液,请计算此时溶液中的溶质质量分数。(写出计算过程,计算结果保留至0.1%)。

氢氧化钠、氢氧化钙是两种常见的碱。
(1)它们有一些相似的化学性质,其原因是溶液中都含有 。
(2)可作某些气体干燥剂的是 。
(3)用氢氧化钙溶液检验二氧化碳,反应的化学方程式为 。
(4)根据化学方程式计算,用7.4kg氢氧化钙能中和硫酸厂排放的污水中硫酸的质量是多少?
向CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液,生成沉淀的质量变化与加入Na2CO3溶液质量关系如图所示,请回答问题:
(1)生成沉淀质量为 g。
(2)求所用Na2CO3溶液的溶质质量分数(计算结果保留一位小数)

某工厂化验室欲测定排放的废水中硫酸的含量(假设废水中只有硫酸与氢氧化钠发生反应)。现取一定量的废水样品,逐滴加入溶质质量分数为10%的氢氧化钠溶液,振荡,当加入氢氧化钠溶液40g时溶液呈中性。求这一定量废水中含H2SO4的质量是多少?( 反应的化学方程式:H2SO4+2NaOH=Na2SO4+2H2O )
氢化钙(CaH2)是种白色细颗粒状固体,能与水发生剧烈反应,其反应的化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,常用作登山运动员的能源提供剂。某化学实验小组为了探究氢化钙的性质,将一定量的CaH2加入到碳酸钠溶液中,立即产生大量气泡,且溶液变浑浊。充分反应后过滤,得到滤渣和滤液,滤渣的主要成分是 (填写化学式)。
为进步确定滤液中所含溶质的成分,他们进行了以下实验探究。
【提出猜想】猜想一:NaOH:猜想二:NaOH和Na2CO3;
猜想三: ; 猜想四:NaOH、Na2CO3、Ca(OH)2
经过分析,大家一致认为上述猜想 不需要验证,肯定是错误的,原因是 (用化学方程式表示)。
【实验探究】
方案一:取一定量的滤液于试管中,往其中滴加少量稀盐酸,无明显实验现象。
方案二:取一定量的滤液于另一试管中,往其中滴加氯化钡溶液,观察到有白色沉淀产生。
【讨论交流】根据实验现象,得出猜想 是正确的。请解释方案一中无明显现象的原因是 。
【拓展探究】上述小组同学将5g氢化钙样品(所含杂质不参与反应也不溶于水)加入到50g碳酸钠溶液中,充分混合后,恰好完全反应。实验测得反应过程中产生气体的质量为0.4g。计算:
(1)样品中CaH2的质量分数为 。
(2)原碳酸钠溶液中溶质的质量为 。
(3)反应后溶液中溶质的质量分数为 。(计算结果保留一位小数)