某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液20g,加入二氧化锰0.5g,完全反应后,称得烧杯内剩余物质的总质量为19.7g。请回答下列问题:
(1)二氧化锰在反应中的作用是__________________。
(2)计算该过氧化氢溶液中溶质的质量分数。
(3)利用上述溶液配制100g溶质质量分数为3%的过氧化氢消毒液,需该溶液的质量为__________g(结果保留一位小数)。
某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图所示装置,对获得的铜粉(含炭)样品进行实验,测定铜的质量分数。图中铁架台等装置已略去。请回答下列问题: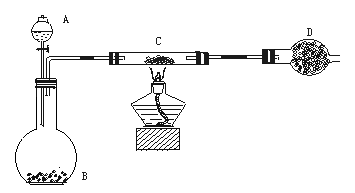
仪器:铁架台(含铁圈、铁夹)、分液漏斗、平底烧瓶、硬质玻璃管、干燥管、酒精灯、石棉网、洗气瓶等。
药品:红褐色(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰(固体氢氧化钠和氧化钙的混合物,可用来吸收水和CO2)。
(1)除上述仪器外,实验中还必须用到的仪器是;
(2)实验操作前,首先进行检查。在C中加入样品粉末W g,D中装入药品后并称量为m1 g,连接好仪器。打开A的上塞、活塞,慢慢滴加溶液。对C进行加热。当C中药品充分反应后,关闭A的活塞,停止加热。冷却后,称量D的质量为m2 g。实验进行的过程中,装置C中发生的主要化学反应类型;充分反应后装置C中剩余的固体成分是。
(3)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与C之间加入一个装置,该装置作用是。
(4)有学生提出直接用右图装置,在空气中直接加热进行实验。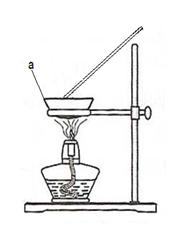
图中仪器“a”的名称为。
若取20g铜粉(含炭)样品进行实验,充分反应后,仪器a中剩余的固体质量为24g,计算求原来混合物中铜的物质的量以及铜的质量分数。
(要求:根据化学方程式计算,并写出计算过程!)
将一定量的石灰石放入烧杯中,加入一定量的稀盐酸,恰好完全反应,产生4.4g气体,反应后所得溶液的溶质的质量分数为20%.(杂质不溶于水,也不参与反应)计算:反应前稀盐酸的溶质的质量分数.(结果精确到0.1%)
宇航员在太空舱中,往往可利用自己呼出的二氧化碳与过氧化钠粉末作用来获得所需的氧气,(反应方程式为2Na2O2 + 2CO2 = 2Na2CO3 + O2)。假如某宇航员在某次太空飞行中预计消耗氧气480kg,请计算该宇航员在太空舱中至少应准备的过氧化钠的质量。(请写出计算过程)
下面是工厂苛化法生产烧碱的示意图。
(1)在实验室,操作Ⅰ的名称是;经操作Ⅰ得到废渣的主要成份是(写化学式)。
(2)物质X中各元素的质量比表示为。
(3)某工厂化验员向含有1.6 g氢氧化钠的溶液中,逐滴加入20.0 g盐酸至氢氧化钠和盐酸恰好完全反应。求盐酸中溶质的质量分数为多少?(写出过程)
(4)若用1.6 g上述得到的固体烧碱产品(含杂质)代替1.6 g氢氧化钠,逐滴加入上述相同浓度盐酸至反应物恰好完全反应,则消耗盐酸的质量20 g(填“大于”、“等于”或“小于”)。
将6.8 g含杂质的锌粒,加入到盛有50.0g过量的稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为56.6 g。试计算
⑴生成氢气的质量。
⑵锌粒中所含锌的质量分数(精确到0.1%)。(Zn-65 H-1)
造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。为测定此废水中氢氧化钠的质量分数,工作人员取了40g废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,消耗稀硫酸49 g。计算废水中氢氧化钠的质量分数。
人类的生产和生活都离不开金属。
Ⅰ.金属元素在自然界中分布很广,在地壳中主要以矿物形式存在。下列矿石的主要成分不属于氧化物的是(填序号)。
Ⅱ.铁是应用最广泛的金属。
(1)下图是工业炼铁示意图。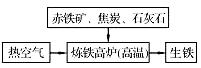
其中,焦炭的作用是燃烧提供能量和;
写出有铁生成的化学方程式。
(2)某兴趣小组在实验室中模拟炼铁的化学原理,用一氧化碳还原纯净的氧化铁粉末,实验装置如图。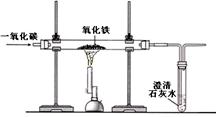
①实验中玻璃管里固体粉末的颜色变化是,澄清的石灰水中发生反应的化学方程式是。
②该装置有何不妥?。
(3)该化学兴趣小组的同学利用改正后的装置进行探究用500g含氧化铁质量分数为70%的赤铁矿,可以炼出含杂质4%的生铁多少克?
为测定某生理盐水的溶质质量分数,现将生理盐水样品与足量的硝酸银溶液混合,相关实验数据如下表所示(不计损耗):
| 反应前 |
反应后 |
||
| 实验 数据 |
生理盐水样品的质量 |
加入硝酸银溶液的质量 |
过滤后剩余溶液的质量 |
| 130 g |
40 g |
167.13 g |
(1)反应后生成氯化银固体的质量为g。
(2)请计算该生理盐水中含氯化钠的物质的量(根据化学方程式列式计算)。
(3)。
已知碳酸氢钠加热能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解。现有某工厂生产出的一批碳酸氢钠中混有少量的碳酸钠,取4.0g 样品加热到质量不再减少时,共收集到二氧化碳气体0.88g。
(1)写出碳酸氢钠受热分解的化学方程式。
(2)要得到干燥的二氧化碳气体,下图中盛放能吸水的浓硫酸,
生成的气体应从(选填“a”或“b”)端导入。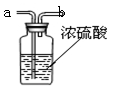
(3)求该样品中碳酸钠的质量分数。(写出计算过程)
(8分)现有Fe和Fe2O3的固体混合物,东东同学为了分析混合物中Fe和Fe2O3的含量,设计了如下实验方案:(注意:100g是Fe与Fe2O3两种物质的总质量)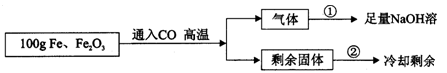
【实验数据】实验共记录了两组实验数据:
第①组,完全吸收气体后,NaOH溶液质量增加了66g;
第②组,完全反应,冷却后称量剩余固体的质量为Wg。
根据实验设计及有关数据进行分析与计算。
(1)根据第①组数据,CO与Fe2O3,反应产生CO2 g。
(2)混合物中Fe2O3的质量为多少?
(3)第②组数据W是g。
为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出)。产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
(1)A点产生气体的质量为;B点对应溶液中所含的溶质有。
(2)试样中碳酸钠的质量分数(结果精确到0.1%);
以下是甲、乙两同学对有关镁与盐酸反应的系列研究。
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是反应(填
“吸热”或“放热”)。
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,
则t1~t2时间内反应速率逐渐加快的主要原因是。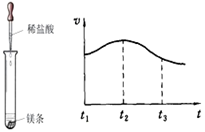
研究二:反应后所得溶液的酸碱性探究:
(3)甲同学反应后用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶
液呈性(选填“酸”“碱”或“中”)。
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。为
验证猜想,甲同学需测定溶液的酸碱性,实验表明该溶液显弱酸性。
(4)乙同学重复甲同学实验时,发现反应后所得试管中溶液pH大于7。发现实验与甲同学实
验不同的是,反应后的试管中镁条有剩余。乙同学猜想可能是镁与热水反应生成了碱性
物质。乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶
液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,
请根据实验现象写出镁与水反应的化学反应方程式。
(5)金属氯化物溶液pH值大小与金属的活动性有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,则氯化钾溶液显性。
(6)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。由
此可见金属与水反应与金属的活动性顺序(填“有关”或“无关”)。
研究三:金属活动性强弱与原子结构的关系:
下图为镁原子、钙原子和钡原子结构示意图。已知其中Ba的活动性最强,据此推测,金属的活动性除与原子的最外层电子数有关,还与有关。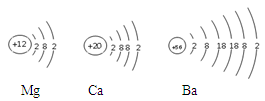
研究四:确定镁条的成分:
称取3.2g表面被氧化的镁条, 放入100g稀盐酸中恰好完全反应,生成气体0.2g。求:
(7)此镁条中金属镁的质量。(写出计算过程,共3分)
(8)反应后所得溶液中溶质的质量分数。(计算结果保留一位小数)
为测定石灰石样品中碳酸钙的含量,小明取25 g石灰石样品与一定质量的14.6%的稀盐酸恰好完全反应,将反应所得混合物蒸干得到固体27.2 g(不含结晶水,假设样品中的杂质既不与稀盐酸反应)。试计算:
(1)参加反应的盐酸的质量。
(2)石灰石样品中碳酸钙的含量。