将0.5克二氧化锰与一定量的氯酸钾共热到质量不再减少为止,称得残渣质量为15.4克。求:(1)生成氧气多少克?
(2)原先氯酸钾的质量为多少克?
某同学向过氧化氢溶液中加入二氧化锰制取氧气,相关数据如下:
| 反应前物质的质量/g |
充分反应后物质的质量/g |
|
| 过氧化氢溶液 |
二氧化锰 |
固体与液体混合物质量 |
| 68.0 |
0.1 |
66.5 |
请计算:
(1)该同学制得氧气的质量为___________。
(2)该同学所用过氧化氢溶液的溶质质量分数。
某化学兴趣小组同学在进行实验室制取氧气时,取了34.0g 过氧化氢溶液,又称取了0.5g二氧化锰,放入烧杯中至不再产生气泡,称得烧杯内剩余物的质量为33.7g,
求:(1)生成氧气的质量是多少?
(2)参加反应的过氧化氢的质量是多少?
在实验室中制取88克二氧化碳,需要多少克碳酸钙跟适量盐酸反应?若改用含杂质20%的石灰石与盐酸反应(杂质不与盐酸反应),需要这种石灰石多少克?
氯化钡溶液常用来检验硫酸,两者之间发生如下化学反应:BaCl2+H2SO4="BaSO4" ↓+2HCl。某同学将80g氯化钡溶液与20g稀硫酸混合,恰好完全反应,过滤后称得稀盐酸的质量为76.7g,求氯化钡溶液的溶质质量分数。
某补钙剂说明书的部分信息如右下图所示。现将有20片该药剂制成的粉末与50g盐酸混合(其他成分不与盐酸反应),恰好完全反应后称得剩余物的质量为65.6g。
(1)青少年缺钙出现的疾病是 。
(2)生成二氧化碳的质量是 g。
(3)参加反应的CaCO3质量为多少?
(4)该盐酸中溶质的质量分数是多少?(精确到0.1%)。
环保石头纸的主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂。
【实验一】 探究影响石头纸与盐酸反应快慢的因素
(1)甲、乙两同学设计实验如下:
| 甲 |
乙 |
|
| 实验过程 |
 |
 |
| 现象 |
试管①、②、③中产生气泡快慢的顺序为:①>②>③。 |
|
| 分析结论 |
Ⅰ 碳酸钙与稀盐酸反应的化学方程式为 ; Ⅱ 对比甲同学实验①②可知, ,化学反应的速度越快; Ⅲ 对比甲同学实验 (填实验序号)可知,反应物的接触面积越大,反应速率越 。 Ⅳ 乙同学的实验中,应该连续记录的实验数据是 和 。 |
【实验二】 测定石头纸中碳酸钙的质量分数提示:石头纸中其他成分均不与盐酸反应,也不溶于水。
(2)甲组同学:图Ⅰ为石头纸与稀盐酸反应的装置,图Ⅱ用于测量通常状况下CO2的体积。
①实验前首先要 ;
② 图Ⅱ装置中油层的作用是 ;
③ 反应完成后,先 (填具体操作),然后才能准确读得量气管中的CO2的体积。
④根据V CO2和ρCO2计算出CO2的质量,计算碳酸钙质量。
(3)乙组同学:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如下表。
| 第1份 |
第2份 |
第3份 |
第4份 |
|
| 取样品质量(g) |
6.25 |
6.25 |
6.25 |
6.25 |
| 取稀盐酸的体积(mL) |
10.0 |
20.0 |
30.0 |
40.0 |
| 产生气体的质量(g) |
0.88 |
1.76 |
2.20 |
m |
通过对数据的分析和比较,回答下列有关问题
①在第 份样品的实验中,样品中碳酸钙完全反应了; 。
② m的值为
③石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品20 g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如图所示。试计算: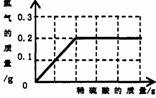
(1)样品中铜的质量分数;
(2)反应所消耗的硫酸溶液质量;
(3)反应后所得溶液中溶质的质量分数。
某化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用2g石灰石样品,把20g稀盐酸(氯化氢的水溶液)分四次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶解于水)充分反应后经过过滤、干燥等操作,最后称量,得实验数据如下:
稀盐酸的用量剩余固体的质量
第一次加入5g 1.5g
第二次加入5g 1.0g
第三次加入5g 0.5g
第四次加入5g 0.3g
(1)从以上数据可知,这四次实验中,第()次石灰石样品中碳酸钙已完全反应。
(2)石灰石样品中碳酸钙的质量分数为 。
(3)求所用稀盐酸的溶质质量分数?(需要有解题步骤和过程)
化学兴趣小组为测定某石灰石样品中碳酸钙的质量分数,取26g石灰石样品放在烧杯中,然后 向其中逐渐加入稀盐酸,使之与样品充分反应,恰好完全反应(杂质不参加反应)时,加入稀盐酸的质量为90g,反应后烧杯中物质的总质量为105g。请计算:
(1)反应生成二氧化碳的质量
(2)样品中碳酸钙的质量分数(结果保留到0.1%)
把干燥的KClO3固体15g与5gMnO2混合均匀,装入大试管中,加热制氧气。待反应一段时间后停止加热,将试管冷却,称量得剩余固体的质量为15.2g。试计算:(1)反应后生成多少克氧气?
(2)反应后剩余固体中含有哪些物质?各多少克?
新的一年,同学们的学习方式有了很大变化。下面是《气体制取与收集》学习的课堂片段:
【自主学习】仿照氧气制取的学习和气体制取的一般思路,阅读课本,老师提供了几组药品,让同学们交流并选出适宜实验室制取二氧化碳的一组。
【合作交流】围绕以上问题,各小组展开了激烈的交流,下面是老师从第二小组同学交流中听到的各位学生的发言:
1号:碳酸盐用块状石灰石(主要成分碳酸钙),为什么不用纯碱(碳酸钠)呢?
3号:碳酸钠是粉未状的,反应的速度太快,不易控制,
2号:同意3号同学的说法,那我们把碳酸钠压制成块状可以吗?
各位都在思考,问题未能解决。
【展示释疑】通过各个小组的展示,大家明白了实验室制取二氧化碳应该选择石灰石和稀盐酸。
实际实验中,所用的原料或产物一般都含有杂质,在计算用料和产量时,应考虑到杂质问题。
请你帮助二组学生解决2号学生提出的问题,实验室把碳酸钠压制成块状_______(选填“可以”或“不可以”)代替石灰石制取二氧化碳。
【能力提升】某小组想测定所用石灰石样品中碳酸钙的质量分数,取用了2g的石灰石样品,把20g稀盐酸(氯化氢的水溶液)分4次加入样品中,(样品中除碳酸钙外,其余成分既不与盐酸反应,也不溶解于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
| 稀盐酸的用量 |
剩余固体的质量 |
| 第一次加入5g |
1.5g |
| 第二次加入5g |
1.0g |
| 第三次加入5g |
0.5g |
| 第四次加入5g |
0.3g |
(1)从以上数据可知,这四次实验中,第______次石灰石样品中碳酸钙已完全反应。
(2)求石灰石中碳酸钙的质量分数?
(3)求检测过程中所产生二氧化碳的质量?