六硅酸镁可表示为 。确定六硅酸镁组成的方法是:取10.6g六硅酸镁,充分加热失水后,得到固体8.8g;另取相同质量的六硅酸镁加入足量盐酸,充分反应后,经处理得 固体7.2g.下列说法正确得是()
| A. | a=2 | B. | a=3 | C. | a=5 | D. | a=7 |
已知: 和 两种物质共80g ,在一定条件下恰好完全反应,生成Z与W的质量比为11︰9,且反应中消耗 的质量是生成 的质量的4/9,则反应中消耗 的质量为()
| A. | 16g | B. | 36g | C. | 44g | D. | 64g |
将3.6 gCaCO3高温煅烧一段时间后冷却,测得固体剩余物中钙元素的质量分数为57.6%,则固体剩余物中氧化钙的质量是
| A.1.44g | B.2.5g | C.1.4g | D.2.016g |
4.6g某化合物在足量的氧气中充分燃烧,生成8.8g二氧化碳和5.4g水。下列有关该化合物组成的判断中正确的是
| A.一定含有碳、氢两种元素,一定没有氧元素 |
| B.一定含有碳、氧两种元素,一定没有氢元素 |
| C.一定含有碳、氢两种元素,可能含有氧元素 |
| D.一定含有碳、氢、氧三种元素 |
X在一定条件下可转化为Y和Z,其反应的微观示意图如下。下列说法中正确的是
| A.X、Y、Z都是有机物 | B.X中碳、氢元素的质量比是1:3 |
| C.X可由淀粉转化得到 | D.Y是最简单的有机化合物 |
向MgO和CuO的混合物8 g中加入稀硫酸至恰好溶解,再向所得溶液中加入NaOH溶液至恰好沉淀完全,生成Mg(OH)2和Cu(OH)2沉淀的总质量为10.7 g,则参加反应的NaOH的质量为
| A.8.0 g | B.12.0g | C.16.0g | D.18.0g |
在CO、CO2混合气体中,氧元素的质量分数为64%。将该混合气体5g通过足量的灼热氧化铜,充分反应后,气体再全部通入足量的澄清石灰水中,得到白色沉淀的质量是
| A.5g | B.10g | C.15g | D.20g |
等质量的X、Y两种金属分别和足量的同体积、同浓度的盐酸反应,产生气体的质量与时间的关系如图所示.下列说法中不正确的是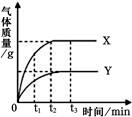
| A.t1时,产生气体的质量:X>Y |
| B.t2时,消耗金属的质量:X>Y |
| C.t3时,消耗金属的质量:X=Y |
| D.t3时,消耗盐酸的质量:X=Y |
巳知反应前后分子变化的微观示意图如下所示。下列说法错误的是
A.此反应中化学计量数之比: (CH4):
(CH4): (O2)等于5:2
(O2)等于5:2
B.A是有机物,C、D是无机物
C.点燃前,要先检验A的纯度,防止爆炸
D.化学方程式CH4 + 2O2  CO2 + 2H2O
CO2 + 2H2O
甲烷在一定量的氧气中燃烧,测得反应前后各物质的质量如下表所示:
| 物质 |
甲烷 |
氧气 |
水 |
二氧化碳 |
X |
| 反应前质量/g |
3.2 |
11.2 |
0 |
0 |
0 |
| 反应后质量/g |
0 |
0 |
7.2 |
4.4 |
a |
下列判断正确的是
A.表中a的值为2.6 B.X一定是该反应的催化剂
C.X可能含有氢元素 D.X一定含有氧元素
把5.1g镁和铝的合金加入到一定质量、一定质量分数的稀硫酸中,恰好完全反应,产生0.5gH2,向反应后的溶液中加入一定量的NaOH溶液,恰好使上述溶液中的MgSO4、Al2(SO4)3完全转化为沉淀,则同时生成的Na2SO4的质量为
| A.32.5g | B.35.5g | C.40.5g | D.45.5g |
在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。下列关于此反应的认识,正确的是:
| 物 质 |
X |
Y |
Z |
W |
| 反应前的质量(g) |
20 |
m |
16 |
14 |
| 反应后的质量(g) |
4 |
6 |
60 |
50 |
A.m的数值为64
B.若W为水,则X或Y必定为酸或碱
C.参加反应的X与Y的质量比为1︰4
D.若X为化合物,Y为单质,则该反应一定为置换反应
在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示,下列说法错误的是
| 物 质 |
a |
b |
c |
d |
| 反应前质量(g) |
10 |
10 |
10 |
2 |
| 反应后质量(g) |
待测 |
2 |
21 |
2 |
A.该反应是化合反应,d可能是催化剂
B.a、b两种物质中元素种类一定与c物质中元素种类相同
C.b物质可能是单质
D.反应后a物质的质量为3g
将一定质量的甲烷和一氧化碳的混合气体在足量的氧气中充分燃烧,将生成物依次通入盛有足量浓硫酸和氢氧化钠溶液的洗气瓶,实验测得装有浓硫酸的洗气瓶增重5.4克;装有氢氧化钠溶液的洗气瓶增重8.8克。混合气体中甲烷和一氧化碳的质量之比为
A、12:7 8、1:1 C、5:13 D、3:8