兴趣小组对实验室制取二氧化碳的废液进行了探究,最终确认废液中的溶质为CaCl 2和HCl。已知CaCl 2溶液呈中性。某同学取了一定质量的该废液于烧杯中,并向其中逐滴加入Na 2CO 3溶液,以下坐标图是他对烧杯中物质变化情况的分析图,其中明显不合理的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
烧杯中盛有锌粉和铁粉的混合物mg,向其中逐渐加入一定浓度的稀盐酸,测得剩余固体的质量与加入稀盐酸的体积的关系如图所示。下列有关结论正确的是( )
①加入V1mL稀盐酸时,剩余固体中不含锌
②加入V2mL稀盐酸时,溶液中的溶质为FeCl3和ZnCl2
③整个过程中发生反应均为置换反应
④反应中产生氢气的质量一定小于 g
g
⑤剩余固体质量m、n与稀盐酸的体积V1、V2的数量关系为 =
=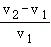

A.①②③④B.①③④C.①③⑤D.①③④⑤
已知一包铁粉中含有两种杂质,小明同学取5.6g该粉末,向其中加入足量的稀硫酸,充分反应后,得到0.5g氢气。则该样品中的杂质可能是( )
A.Mg和ZnB.Al和ZnC.Zn和CuD.Mg和Cu
向盛有硫酸和硫酸铜混合溶液的烧杯中滴入Ba(OH) 2溶液,烧杯中溶质的质量与加入的Ba(OH) 2溶液的质量关系如图所示。下列有关说法正确的是( )
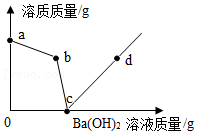
| A. |
a→b段溶液的质量一定减小 |
| B. |
b→c段有水生成 |
| C. |
b点溶液溶质为硫酸铜 |
| D. |
d点沉淀质量与b点沉淀质量相等 |
在5.6g铁粉中,先逐滴加入一定量的Cu(NO 3) 2溶液,充分反应后再逐滴加入AgNO 3溶液,剩余固体质量与所加溶液总质量的关系如图所示。下列说法正确的是( )
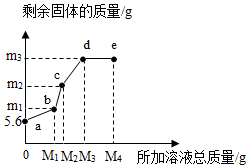
| A. |
所加溶液质量为M 1g时,生成Cu的质量为m 1g |
| B. |
bc段发生的是Cu和AgNO 3溶液的反应 |
| C. |
m 3的值为21.6 |
| D. |
e点溶液中不含Cu(NO 3) 2 |
下列图像与对应的叙述,相符合的是( )
A.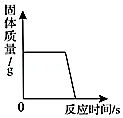 高温煅烧石灰石
高温煅烧石灰石
B. 氢气和氧气在密闭容器中燃烧
氢气和氧气在密闭容器中燃烧
C.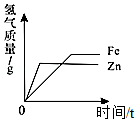 向等质量的铁粉和锌粉中分别加入等质量分数的稀硫酸至过量
向等质量的铁粉和锌粉中分别加入等质量分数的稀硫酸至过量
D. 在一定温度下,向硝酸钾的饱和溶液中加入硝酸钾晶体
在一定温度下,向硝酸钾的饱和溶液中加入硝酸钾晶体
如图所示四个图像对应的变化过程正确的是( )
A. 气体物质的溶解度与温度和压强的关系
气体物质的溶解度与温度和压强的关系
B. 浓硫酸长时间露置于空气中
浓硫酸长时间露置于空气中
C.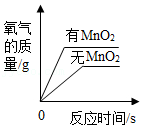 用等质量、等浓度的过氧化氢溶液分别制取氧气
用等质量、等浓度的过氧化氢溶液分别制取氧气
D.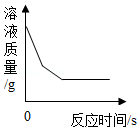 向足量的硫酸铜溶液中加入铁和镁固体混合物
向足量的硫酸铜溶液中加入铁和镁固体混合物
为测定某石灰石样品中碳酸钙的质量分数,取2.0g石灰石样品于烧杯中,将20g稀盐酸分4次加入样品中,充分反应后经过滤,干燥、称重,得实验数据如表:
|
第一次 |
第二次 |
第三次 |
第四次 |
|
|
稀盐酸的用量/g |
5.0 |
5.0 |
5.0 |
5.0 |
|
剩余固体的质量/g |
1.5 |
1.0 |
0.5 |
0.3 |
已知石灰石中的杂质既不与盐酸反应,也不溶解于水。下列说法正确的是( )
A.第三次实验后碳酸钙无剩余
B.第四次实验后盐酸无剩余
C.盐酸中HCl的质量分数是3.65%
D.样品中碳酸钙的质量分数是85%
将一定质量的Na 2CO 3和NaOH混合物与60g质量分数为18.25%的盐酸混合,两者恰好完全反应,收集到4.4g气体,则原混合物中NaOH的质量为( )
| A. |
2g |
B. |
3g |
C. |
4g |
D. |
5g |
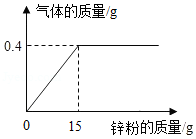
向133.4克稀盐酸中加入锌粉(仅含不溶于酸的杂质),所加锌粉的质量与产生气体的质量的关系如图所示。求:
(1)此过程产生气体的最大质量是 ;
(2)原稀盐酸中溶质的质量分数为多少?(请写出计算过程)
在反应2A+B═3C+D中,A和B的相对分子质量之比为5:1,已知20gA与一定量B恰好完全反应,生成5gD,则在此反应中B和C的质量比为()
| A.4:19 | B.3:5 | C.1:3 | D.2:17 |
一定质量的木炭在氧气和氮气的混合气体的密闭容器中燃烧产生CO和CO2,且反应后测得混合气体中碳元素的质量分数为24%,则其中氮气的质量分数不可能为
| A.10% | B.20% | C.30% | D.40% |
为了测定液化气中丙烷(C3H8)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表
| 物质 |
丙烷 |
氧气 |
水 |
二氧化碳 |
X |
| 反应前质量/g |
4.4 |
12.8 |
0 |
0 |
0 |
| 反应后质量/g |
0 |
0 |
7.2 |
4.4 |
a |
下列判断正确的是
A.X可能含有氢元素 B.X可能是该反应的催化剂
C.表中a的值为5.6 D.X只含碳元素
氯酸钾和二氧化锰的混合物15g,加热充分反应后剩余固体的质量为10.2g,则原混合物中氯酸钾的质量为( )
| A.10.2g | B.2.75g | C.4.8g | D.12.25g |