实验室以一种工业废渣(主要成分为MgCO3、MgO和SiO2)为原料制备MgCO3•3H2O.其主要实验过程如图:

已知:SiO2不溶于水,常温下不与硫酸、碳酸钠反应。
(1)“酸溶”时发生反应的化学方程式为 和 。
(2)“过滤Ⅱ”所得滤液中含有的主要离子有 (填离子符号)。
(3)“反应”步骤前后均有过滤,能否省去“过滤Ⅰ”只进行“过滤Ⅱ”。 (填“能”或“否”),理由是 。
(4)“酸溶”时所加硫酸溶液不宜过量太多的原因是 。
“庄稼一枝花,全靠肥当家”。近年来,随着农业生产的不断发展,对硫酸镁( MgSO4)肥料的需求量逐年上升。以氧化镁矿粉(主要成分氧化镁,还含有少量氧化铁、烧碱等杂质)和浓硫酸为原料,生产MgSO4的部分生产流程如图1所示。已知氧化镁与硫酸发生反应的化学方程式为:MgO+H2SO4═MgSO4+H2O.分析制备过程,回答下列问题:
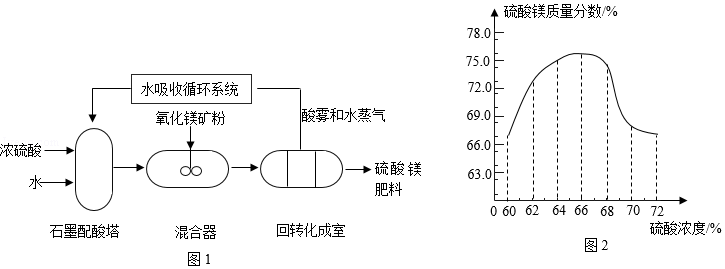
(1)图1中,石墨配酸塔由石墨制成,说明石墨具有的性质是 。
(2)生产中,稀硫酸与杂质发生反应的化学方程式为 。
(3)回转化成室中发生的化学反应会 (填“吸收热量”或“放出热量”)。
(4)分析图2,使用硫酸的最佳浓度为 。
(5)生产过程无废物排放,符合绿色化学要求,其中可循环利用的物质是 。
纽扣电池是生活中常用的电源,如图是银锌纽扣电池的构造示意图,回答下列问题。
(1)纽扣电池的外壳可以加工得很薄,说明金属具有 性。
(2)氧化银加热分解可以得到两种单质,其化学反应方程式为 。
(3)该电池中涉及的铁、锌、银三种金属,它们的金属活动性由强到弱的顺序是 ,为了验证该结论,某同学向质量、外形相同的铁片、锌片、银片中分别加入足量15%的稀盐酸,以下现象中不能成为该结论证据的是 (填序号)。
A.银表面没有气泡生成
B.铁表面最终生成气体的总量比锌多
C.铁表面产生气泡的速率比锌慢

根据如图回答问题。

(1)反应原理
①加热高锰酸钾、分解过氧化氢溶液或加热氯酸钾均可产生氧气,其中分解过氧化氢溶液和加热氯酸钾时,加入二氧化锰在反应中起的作用是 。三种方法中,写出其中一个反应的化学方程式 。
②石灰石和稀盐酸反应产生二氧化碳的化学方程式为 。
(2)制取O2和CO2.连接如图的装置完成实验。
制取气体 |
A |
B |
C |
||
反应物 |
装置(填“甲”或“乙”) |
物质 |
作用 |
作用 |
|
O2 |
① |
② |
水 |
③ |
接水 |
CO2 |
石灰石和稀盐酸 |
乙 |
④ |
干燥CO2 |
⑤ |
2019年1月3日嫦娥四号探测器成功着陆在月球背面,并通过“鹊桥”中继星传回了近距离拍摄的月背影像图,揭开了月背的神秘面纱。“鹊桥”号上伞状通信天线是用表面镀金的钼丝编织而成的金属网。这种镀金钼丝纤维只有头发丝四分之一细,其性能稳定。“编”出来的金属网既强韧,受得住发射飞行外力“折腾”,又能在太空中收放自如,可以说是“刚柔并济”。
(1)钼能制成细丝,是利用了钼 性。
(2)钼丝表面镀金,原因之一是利用了金的化学性质 。
(3)我国的钼矿储量非常丰富,用辉钼矿(MoS2)制备的过程如图

①完成过程I中反应的化学方程式:2MoS2+7O2 2MoO3+4 。
②过程Ⅱ分两个阶段:
第一阶段反应中反应物与生成物的化学计量数之比为1:1:1:1
写出下列化学方程式
第一阶段 。
第二阶段 ,该反应的基本反应类型为 。
用化学用语填空:
(1)氦气 ;
(2)2个氢离子 ;
(3)2个硫酸分子 ;
(4)地壳中含量最多的金属元素是 ;
(5)铁丝在氧气中燃烧的化学方程式 。
化学的基本特征是研究和创造物质。试从科学家认识物质的视角认识CO2。
(1)分类角度
CO2属于 (填字母)
a.单质 b.氧化物 c.有机物
(2)微观角度
我国研制的一种新型催化剂可将CO2和H2转化为甲醇(CH3OH)和X.若用“O”表示氢原子,“ ”表示氧原子,“
”表示氧原子,“ ”表示碳原子,该反应的微观示意图如图:
”表示碳原子,该反应的微观示意图如图:

画出X分子的微观示意图: (用0.5mm黑色墨水签字笔作答)。
(3)性质角度
三百多年前,人们发现一些洞穴内有一种能使燃烧的木柴熄灭的气体,后来该气体被证实是CO2.据此推测CO2具有的化学性质是 。
(4)变化角度
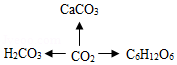
如图是某同学整理的物质转化图;实验室中常用CO2→CaCO3检验CO2气体,写出其化学反应方程式
(5)应用角度
I.可用如图所示方法自制汽水来消暑解热

制汽水时,NaHCO3与柠檬酸反应生成柠檬酸钠、二氧化碳和水。
①据此推测,通常条件下不能与柠檬酸反应的物质 (填字母)。
a.镁带 b.氯化钠 c.烧碱
②打开汽水瓶盖时汽水会自动喷出来。说明气体在水中的溶解度与 有关。
Ⅱ.Al﹣CO2电池是一种新型电池。
③电池的工作原理:在O2的催化下,Al与CO2发生化合反应生成Al2(C2O4)3.写出此反应的化学方程式 。
(6)环保角度
全球参与控制CO2的排放量是防止温室效应进一步增强的根本对策。下列限制CO2排放量的做法不合理的是 (填字母)。
a.制定旨在限制CO2排放的国际规定
b.减少化石能源的使用,开发太阳能等新能源
c.工厂通过加高烟囱直接排放含CO2的废气
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)

回答下列问题:
(1)SO3和H2SO4中,硫元素的化合价均为 ;
(2)反应④为化合反应,该反应的化学方程式为 ;
(3)根据图示判断,下列说法正确的是 。
A.雾霾的形成只与燃料燃烧直接产生的颗粒物有关
B.使用清洁燃料,减少SO2和NOx的排放,有利于减少雾霾的产生
中和反应是一类重要的化学反应。某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。

(1)烧杯中发生反应的化学方程式为 ;
(2)仪器A中溶液的溶质是 (填化学式);
(3)图3中V的数值最接近 (填“6”、“12”或“16”);
(4)下列说法错误的是 。
A.图2中b点所示溶液中的溶质是NaCl和NaOH
B.取图2中d点所示溶液加热蒸干所得固体为纯净物
C.图2中c→d所示溶液中NaCl的质量不断增加
D.图3中e→f变化趋势可说明该反应是放热反应
酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的硝酸钡、碳酸钠、氢氧化钾、稀硫酸、氢氧化钙五瓶无色溶液,现将其任意编号A、B、C、D、E,然后两两混合进行实验,其部分现象如下表(微溶物视为可溶物)。
实验 |
A+E |
A+B |
B+C |
B+E |
现象 |
产生沉淀 |
产生沉淀 |
产生沉淀 |
产生气体 |
①碳酸钠俗称纯碱,属于 类(填字母序号)。
A.酸
B.碱
C.盐
②写出溶液B中溶质的化学式 。
③写出溶液A与E反应的化学方程式 。
(2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:NaCl+H2O+NH3+CO2═NaHCO3↓+X;2NaHCO3 Na2CO3+H2O+CO2↑等。则X的化学式为 。
Na2CO3+H2O+CO2↑等。则X的化学式为 。
2021年3月,四川“三星堆遗址”已出土黄金面具、青铜艺术品、象牙、残存的丝织品等重要文物,其中青铜为合金。
(1)下列物质中属于金属材料的有 (填序号)。
A.象牙
B.黄金
C.丝织品
D.青铜
(2)青铜的硬度比纯铜 (填“大”或“小”)。
(3)铜制品长期暴露在空气中能与空气中的O2、H2O和 化合生成铜锈【主要成分是Cu(OH)2CO3】。
(4)黄铜是铜锌合金,区分黄铜和纯铜发生反应的化学方程式为 。
根据如图回答问题。

(1)反应原理
①加热高锰酸钾、分解过氧化氢溶液或加热氯酸钾均可产生氧气,其中分解过氧化氢溶液和加热氯酸钾时,加入二氧化锰在反应中起的作用是 。三种方法中,写出其中一个反应的化学方程式 。
②石灰石和稀盐酸反应产生二氧化碳的化学方程式为 。
(2)制取O2和CO2.连接如图的装置完成实验。
制取气体 |
A |
B |
C |
||
反应物 |
装置(填“甲”或“乙”) |
物质 |
作用 |
作用 |
|
O2 |
① |
② |
水 |
③ |
接水 |
CO2 |
石灰石和稀盐酸 |
乙 |
④ |
干燥CO2 |
⑤ |
化学与生产、生活密切相关。回答下列问题:
(1)宜宾芽菜因风味独特深受消费者喜爱。某品牌芽菜是由青菜、食用盐、食糖、食品添加剂等混合腌制而成,其营养成分如下表:
营养成分表
项目 |
每100克 |
能量 蛋白质 脂肪 碳水化合物 钠 |
925千焦 18克 0克 524克 1860毫克 |
①营养成分表中的“钠”是指 (选填“原子”、“分子”或“元素”),主要来源于 。
②从营养成分表可知,提供能量的主要物质是 。
③该品牌芽菜的外包装袋是由聚丙烯制成,聚丙烯属于 (填字母序号)。
A.天然高分子材料
B.有机合成材料
C.金属材料
(2)从源头上减少和消除污染是“绿色化学”的重要理念。工业燃煤会产生大气污染物SO2,为减少SO2的排放,煤燃烧时加入生石灰进行“固硫”。
①化石燃料包括煤、 和天然气。
②SO2造成的环境污染问题主要是 。
③煤燃烧时需不断鼓入空气,“固硫”最终生成CaSO4.“固硫”的化学方程式是 。

2020年,罕见的新冠病毒疫情爆发,各种消毒剂如酒精、二氧化氯、过氧乙酸等被广泛使用,根据所学知识回答下列问题。
(1)使用酒精消毒时,要注意安全,避免失火,酒精(C2H5OH)在空气中完全燃烧的化学方程式为 。
(2)二氧化氯(ClO2)具有强氧化性,可发生反应:6ClO2+16NH3═5R+6NH4Cl+12H2O,则R的化学式为 。
(3)过氧乙酸(CH3COOOH)中碳元素与氢元素的质量比为 。过氧乙酸溶液中通常还含有过氧化氢、醋酸等物质,向过氧乙酸溶液中加入下列物质,不能产生气体的是 。
A.CuSO4
B.NaCl
C.Na2CO3
D.MnO2