火是文明的起源,取火的方法经过了漫长的演变过程。
(1)古代人使用的“火折子”吹气即可燃,“火折子”的制作材料中有硫磺。硫燃烧的化学反应方程式为 。
(2)1830年,法国人发明了摩擦火柴,将白磷、硫、KClO3、MnO2混合做火柴,摩擦生热使白磷燃烧,利用白磷燃烧的热量使KClO3分解,然后是硫燃烧。该过程中KClO3分解的化学反应方程式为 。推测摩擦过程中白磷比硫先燃烧的原因是 。
(3)19世纪中期,瑞典人创制出安全火柴,将红磷涂在火柴盒的摩擦面上,硫、KClO3、MnO2则藏于火柴头中。火柴划燃的瞬间,火苗异常旺,对产生此现象的原因推测不合理的是 (填序号)。
A.火柴头里的硫比火柴梗燃烧更剧烈
B.MnO2分解产生氧气助燃
C.KClO3分解产生氧气助燃
2020年中国首次火星探测,利用火星车一次实现“环绕、着陆、巡视”三个目标,这是其他国家第一次实施火星探测从未有过的,面临的挑战也是前所未有的。(火星车模型如图)。
(1)硅片太阳能电池板在日光照射下或跟空气、水分接触时都不容易发生反应,则硅必备的化学性质 (选填“较活泼”或“稳定”)。
(2)火星车采用钛合金、铝合金、复合记忆纤维等材料制造,为保证火星车在火星上着陆并正常工作,钛、铝合金应具有密度小、硬度 、耐腐蚀等优良性能;铝的化学性质很活泼,但铝制品却很耐腐蚀的原因是 。
(3)火星大气中二氧化碳含量高,二氧化碳在一定条件下能发生反应生成一氧化碳和氧气,该反应的化学方程式 ,所属的基本反应类型为 ,生成的一氧化碳可解决火星探测器的燃料问题。

金属在生产、生活和社会发展中的应用较为广泛。
(1)铜丝、铝丝常用作导线,是因为它们具有良好的 性。
(2)早在明代宋应星所著的《天工开物》里就对铁器的生产和使用有所记载,到了现代,炼铁技术得到进一步发展。炼铁的原理是利用一氧化碳与氧化铁的反应,请写出该反应的化学方程式 ,该反应 (填“属于”或“不属于”)置换反应。
(3)钢窗表面喷漆不仅美观,而且可有效防止铁与空气中的 接触而生锈。
(4)某同学对含X、Y、铜、银四种金属的混合物进行如图探究,根据实验流程回答下列问题:
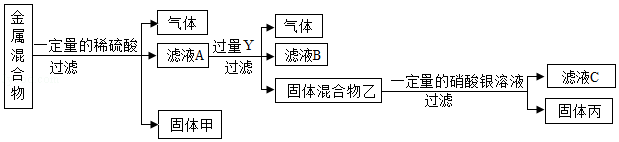
①四种金属的活动性由强到弱的顺序是 ;
②滤液C中所含溶质的成分可能有 种情况。
实验室制取氯化氢气体采用:硫酸(浓)+氯化钠 氯化氢+硫酸钠,其反应的化学方程式为 ,干燥的氯化氢不能使干燥的蓝色石蕊试纸变红,说明干燥的氯化氢气体中 (填“有”或“没有”)H+。
复学防疫,化学助力。
(1)起床后,测体温。测体温时水银体温计中汞柱会上升的微观原因是汞原子 。
(2)上学时,戴口罩。制作口罩用的无纺布面料主要是聚丙烯[(C3H6)n],聚丙烯中碳、氢元素的质量比为 。
(3)到校后,勤消毒。过氧乙酸用于教室消毒,其化学性质不稳定,分解的化学方程式为:2C2H4O3═2C2H4O2+X↑,则X的化学式为 。用于手部消毒的酒精溶液属于易燃物,使用时要注意安全,酒精燃烧的化学方程式为 。
(4)用餐时,讲营养。如午餐仅食用米饭、红烧肉、鸡蛋汤、牛奶,从均衡营养角度出发还应补充的一种食物是 。
海水、河水或湖水中,都溶解了一定量的氧气,但养鱼池中或长途运输活鱼常常由于鱼多而缺氧,因此要设法增加水中的氧气含量。
材料一:已知过氧化钠(Na2O2)与水较快反应,反应方程式是2Na2O2+2H2O═4NaOH+O2↑
过氧化钙(CaO2)与Na2O2性质相似,与水缓慢反应放出氧气。
材料二:20℃时,NaOH的溶解度为109g,Ca(OH)2的溶解度为0.165g。
(1)试写出CaO2与H2O反应的化学方程式 ;
(2)长途运输活鱼,人们选择CaO2而不选择Na2O2作增氧剂的理由可能是 (写出一条即可)。
实验室可利用Zn与稀硫酸的反应制取H2。
(1)用浓硫酸配制稀硫酸的操作为 (填字母),用玻璃棒引流,并不断搅拌。
A.将浓硫酸缓缓注入盛有水的烧杯中
B.将水缓缓注入盛有浓硫酸的烧杯中
(2)Zn与稀硫酸反应的化学方程式为 。
(3)图1所示的仪器B、D的名称为 、 ,组装制取H2的发生装置应选用的仪器为 (填字母)。
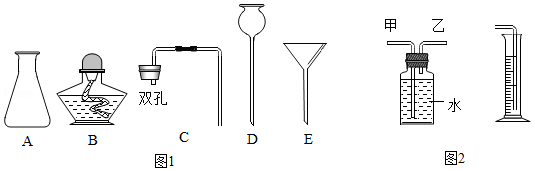
(4)为收集并准确测量H2的体积,在装入药品前,需检查装置的 。
(5)相同条件下H2密度比空气小,利用该性质可以通过 法收集H2,若用图2所示装置测量生成H2的体积,H2应从 (填“甲”或“乙”)管通入。
(6)为探究影响Zn与稀硫酸反应快慢的因素,进行以下三组实验,室温下,取颗粒大小相同的锌粒与足量的稀硫酸反应,测量产生10mL H2(通常状况)所需的时间,下表为实验数据:
实验编号 |
硫酸的质量分数/% |
硫酸的体积/mL |
锌粒的质量/g |
时间/s |
1 |
10 |
10 |
1 |
78 |
2 |
10 |
10 |
2 |
57 |
3 |
40 |
10 |
1 |
9 |
①比较实验1、2的数据,可以得出的结论是 。
②由实验数据可知,该实验中对Zn与稀硫酸反应快慢影响较大的因素是 。
③比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的H2所需的时间,还可采用的测量方法是 (写出一种)。
化学就在我们身边,人类的生活离不开化学,回答下列问题。
(1)人们穿的衣服通常是由纤维织成的,下列属于天然纤维的是 。
A.蚕丝 B.涤纶 C.棉花 D.尼龙
(2)水是一种重要的自然资源,是生产、生活必不可少的物质。
①生活中可以通过 的方法,既可以杀灭水中的细菌,又可以降低水的硬度。
②下列各种水中属于纯净物的有 。
A.矿泉水 B.糖水 C.蒸馏水 D.自来水
(3)服用含氢氧化铝[Al(OH)3]的药物可以治疗胃酸过多症,反应的化学方程式为 ,该反应属于 (填基本反应类型)。
(4)吸烟除了影响自身的健康外,也会使周围的人“被动吸烟”,其原因是 (从微观角度解释)。
氢气被看作是理想的能源。氢气的制取和储存是氢能源利用领域的研究热点。
Ⅰ.氢气的制取
(1)科学家正致力于研究在催化剂和光照条件下分解水制氢气。写出该反应的化学方程式: ,该反应 (填“放出”或“吸收”)能量。
(2)水热分解可得氢气,高温下水分解体系中微粒含量与温度的关系如图所示。
图中曲线A、B对应的微粒依次是 (填符号)。
Ⅱ.氢气的储存
(3)一种镁铜合金可用于储氢。
①将镁、铜单质按比例在一定温度下熔炼得到上述合金。熔炼时须通入氩气,其目的是 。
②350℃时,该镁铜合金与氢气反应,生成了一种仅含Mg、H两种元素的化合物,其中氢元素的质量分数为7.7%.该化合物的化学式为 。
金属材料广泛应用于现代社会中。请用相关的知识回答下列问题。
(1)在日常生活、工农业生产和科学研究中,大量使用的是合金。生铁和 就是含碳量不同的两种铁合金。
(2)日常生活中,菜刀一般采用的防锈措施是 。菜刀用铁制而不用铝制的原因是 。
(3)很多金属都能与氧气反应,写出镁在空气中燃烧的化学方程式 。
(4)现有甲、乙、丙、丁四种金属,丁在自然界中只能以单质形式存在,用甲制的容器不能盛放乙的盐溶液,用丙制的容器却可以盛放乙的盐溶液。由此推断四种金属的活动性由强到弱的顺序是 。
铝、铜、铁是生活中常见的金属。
(1)铝在空气中具有良好的抗腐蚀性的原因是 ;
(2)用铜制品电线主要是利用铜具有良好的 性;
(3)焊接铁制品时,通常先用稀盐酸除去铁表面的锈,反应的化学方程式为 。
写出下列反应的化学方程式,并注明反应的基本类型。
(1)水通电制氢气和氧气: , 。
(2)利用红磷燃烧测定空气中氧气的含量: 、 。
(3)用稀盐酸除去工业废水中的氢氧化钠 、 。
纽扣电池是生活中常用的电源,如图是银锌纽扣电池的构造示意图,回答下列问题。
(1)纽扣电池的外壳可以加工得很薄,说明金属具有 性。
(2)氧化银加热分解可以得到两种单质,其化学反应方程式为 。
(3)该电池中涉及的铁、锌、银三种金属,它们的金属活动性由强到弱的顺序是 ,为了验证该结论,某同学向质量、外形相同的铁片、锌片、银片中分别加入足量15%的稀盐酸,以下现象中不能成为该结论证据的是 (填序号)。
A.银表面没有气泡生成
B.铁表面最终生成气体的总量比锌多
C.铁表面产生气泡的速率比锌慢

2020年全球大面积爆发新冠状病毒肺炎疫情。预防新冠状病毒及疫情的扩散,消毒,杀菌很关键。酒精(C2H5OH)可用作消毒剂,也是一种常用的燃料。
(1)酒精是一种 能源(填“可再生”或“不可再生”)。
(2)酒精燃烧的化学方程式为: 。
(3)某同学配制了一瓶酒精消毒剂,经测定此消毒剂中酒精分子与水分子个数比为1:1.此消毒剂中酒精的质量分数为 。
金属的用途很广,我们应该节约和保护金属资源,请用所学化学知识回答下列问题:
(1)铁制品长期裸露在室外易生锈,铁生锈实际上是铁与空气中的 等发生化学反应的过程;
(2)为了预防铁制品生锈,我们常在其表面镀一层抗腐蚀的金属,但在镀金属之前,先要除去铁制品表面的铁锈。用稀盐酸除去铁锈的化学反应方程式是 ;
(3)将X、Z、Y三种金属片分别放入稀硫酸中,Y、Z表面有气泡产生,X没有明显现象,再把Y、Z分别放入FeSO4溶液中,发现放入Y的FeSO4溶液逐渐变成无色,而放入Z的FeSO4溶液和Z表面都没有明显现象。根据上述实验判断,X、Y、Z三种金属的活动性由强到弱的顺序是 。