乙醇俗称酒精,是常见的有机溶剂,在生产生活中有重要的应用。
(1)国家质量技术监督局于2001年发布了《车用乙醇汽油》国家标准。目前丹东地区部分汽车使用乙醇汽油作为汽车燃料,使用乙醇汽油的优点是 (写出一点即可)。
(2)2020年中国人民众志成城抗击新冠肺炎,取得了举世瞩目的胜利。在使用75%乙醇溶液进行消毒杀菌时,使用方法一般为擦拭,如果喷洒可能会 ,乙醇燃烧的化学方程式为 。
实验室现有稀硫酸、稀盐酸、石灰石、锌片等药品及相关仪器,请结合如图的装置回答问题:

(1)写出如图中标有序号的仪器名称:① ;② 。
(2)欲用装置F收集氢气,应该从装置F的 (填“a”或“b”) 端通入气体。
(3)某气体只能用E装置收集,则该气体不能具有的性质是 (填序号)。
A.易溶于水或与水反应
B.能与空气反应
C.密度与空气接近
(4)若用如图中的装置制取二氧化碳,选择的装置组合是 (填字母),该反应的化学方程式是 。
以FeSO4•7H2O为原料制备铁红(Fe2O3)的一种方法如图:

已知“沉淀”时的主要反应为:2FeSO4+H2O2+2H2O═2FeO(OH)↓+2H2SO4
(1)FeO(OH)中铁元素的化合价为 。FeO(OH)可表示为mFe2O3•nFe(OH)3, 。
(2)“沉淀”时需控制溶液的pH与反应的温度。
①“沉淀”时调节溶液的初始pH约为4,过程中应始终保持溶液的pH为3.0~4.5,需不断加入物质Z调节溶液的pH,Z应具备的性质有 (填字母)。
A.能与酸反应
B.能与碱反应
C.不与FeO(OH)反应
②“沉淀”时反应温度不宜过高,其原因是 。
(3)“过滤”后需对固体进行洗涤与干燥。洗涤时被除去的沾于固体表面的阴离子为 (填离子符号)。
(4)“煅烧”时反应的化学方程式为 。
(5)如图为其他条件相同时不同煅烧温度对产品中Fe2O3质量分数的影响。煅烧温度较低时,产品中Fe2O3质量分数较低,其原因是 。当煅烧温度达800℃时,继续升高温度,产品中Fe2O3质量分数降低,且铁元素质量分数升高,所得产品发黑,其可能原因是 。

(6)用该方法制备Fe2O3,计算理论上13.9t FeSO4•7H2O(相对分子质量为278)可制得Fe2O3的质量(写出计算过程)。
CO2是最主要的温室气体,也是巨大的碳资源,CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。
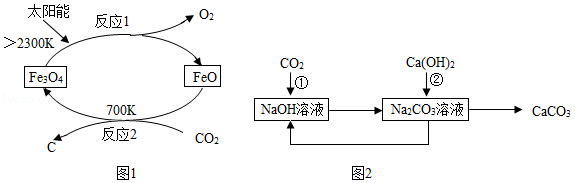
(1)以CO2为原料制取炭黑的太阳能工艺如图1所示。
①反应1的基本类型为 。
②反应2中碳元素的化合价 (填“升高”“不变”或“降低”)。
(2)利用NaOH溶液吸收CO2,部分转化关系见图2。
反应①的化学方程式为 ,该转化中循环使用的物质是 。
(3)利用Na2CO3或K2CO3溶液吸收低浓度的CO2,将其转化为NaHCO3或KHCO3,NaHCO3或KHCO3受热分解生成高浓度的CO2储存利用,生成的Na2CO3或K2CO3循环使用以降低生产成本。
吸收剂 |
Na2CO3 |
K2CO3 |
20℃最高浓度(g/L) |
212 |
1104 |
价格(元/Kg) |
1.25 |
9.80 |
根据表中信息,选择K2CO3溶液作吸收液的优点是 。
(4)利用一种新型“人造树叶”将CO2转化为乙醇(C2H5OH)的反应如下:2CO2+3H2O C2H5OH+3O2,研究显示,1L“人造树叶”每天能从空气中吸收968g CO2,计算1L“人造树叶”工作1天可得到乙醇的质量(写出计算过程)。
(5)某研究小组设计如图3所示实验,探究CO2和H2在一定条件下反应的产物。
查阅资料:①CO2和H2在合适催化剂和一定温度下反应转化为CO和H2O;
②白色无水硫酸铜吸水后变为蓝色。
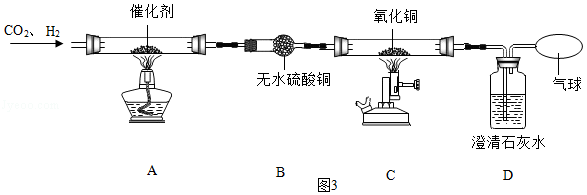
实验过程中观察到的主要现象有:B装置中白色固体变为蓝色,C装置中黑色固体变为红色,D装置中澄清石灰水变浑浊。
①设计B装置的目的是 。
②C装置中发生的反应的化学方程式为 。
③研究小组反思后认为,根据上述实验现象不能确认CO2和H2反应生成了CO,理由是 。
对金属材料的研究,在人类发展的历史长河中起着非常重要的作用。
(1)金属的化学性质。
完成下列反应的化学方程式:
①镁与氧气反应 。
②锌与盐酸反应 。
③铁与硫酸铜溶液反应 。
(2)金属的获得。
①金属氧化物加热分解。
加热氧化银得到银和氧气,写出该反应的化学方程式 。
②一定条件下,金属化合物与一些具有还原性的物质发生反应。在高炉内,把铁矿石冶炼成铁的主要反应原理是 。写出氢气还原氧化铜的化学方程式,并计算若80g氧化铜与氢气完全反应生成铜,理论上最多可得到铜的质量是多少?(在答题卡上写出计算过程)
③电解法冶炼。
工业上可以利用电解熔融氯化钠得到钠和氯气,该反应的基本反应类型是 。
黄铜是由铜和锌组成的合金,可用于制造钱币、机器零件等。利用黄铜制造各种物品的过程中,会产生大量的黄铜渣,主要含有Zn、Cu、ZnO、CuO.一种利用黄铜渣获取金属铜和硫酸锌溶液的实验流程如图:
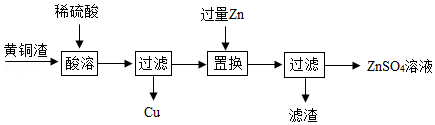
(1)下列关于黄铜的说法正确的是 。
a.黄铜不能被腐蚀
b.黄铜的硬度比铜大
c.黄铜的熔点比锌高
(2)“酸溶”过程中有气体生成,写出生成该气体的化学方程式: 。
(3)“置换”过程中需要加入过量Zn的目的是 。
(4)为进一步提高原料利用率,得到更多的铜和硫酸锌溶液,需要对流程中的“滤渣”进行处理,向滤渣中缓慢加入 (选填“稀硫酸”或“稀盐酸”)并不断搅拌,观察到 时停止加入,过滤。
(5)上述流程中,能判断锌的金属活动性比铜强的事实是 (任写一条)。
我国塑料购物袋的年消耗量很大,废弃塑料的处理亟待解决。回答下列问题。
(1)购物袋等塑料制品的大量使用,可能会造成的一种环境污染是 。
(2)小林尝试用焚烧法对某类塑料购物袋(主要成分是聚氯乙烯)进行处理,并将燃烧产物用氢氧化钠溶液进行吸收。
【查阅资料】Ⅰ.聚氯乙烯的化学式为(C2H3Cl)n。
Ⅱ.氯化氢气体会污染环境
Ⅲ.Na2CO3+CaCl2═CaCO3↓+2NaCl
①聚氯乙烯完全燃烧的化学方程式如下:
2(C2H3Cl)n+5nO2 4nCO2+2nHCl+2nX,则X的化学式为 。
②将完全燃烧后的产物,全部通入到一定量的NaOH溶液中,得到吸收液,写出氢氧化钠溶液吸收氯化氢的化学方程式 。
③小林对吸收液的溶质成分产生了兴趣,进行如下探究:
[提出问题]吸收液中溶质的成分是什么?
[进行实验1]取吸收液少许置于试管中,滴加2~3滴无色酚酞试液,发现酚酞变红色,说明溶液呈 性。
[猜想]猜想1:NaCl、NaOH、Na2CO3
猜想2:
猜想3:NaCl、Na2CO3、NaHCO3
猜想4:NaCl、NaHCO3
[进行实验2]向实验1所得溶液中,加入过量的CaCl2溶液,小林观察到 (填实验现象),最终得出结论:猜想1正确。
[交流反思]实验结束后,小林对吸收液进行无害化处理,其方案是 ,然后倒入废液缸。
咨询老师后,小林获悉废弃塑料的资源化回收是减少环境危害的最好方法。
(3)聚氯乙烯的生产需要用到氯气。工业上获取氯气的方法是电解饱和食盐水,发生反应的化学方程式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑.某工厂需生产14.2t氯气(Cl2),至少需要氯化钠的质量为多少?(请写出计算过程)
2020年6月23日,我国长征五号B运载火箭搭载第55颗北斗导航卫星发射成功,北斗三号全球卫星导航系统星座部署全面完成。
Ⅰ.火箭中液氢燃料通过氢泵涡轮高速输送到发动机燃烧室,与液氧混合燃烧产生推动力。该反应的化学方程式为 。
Ⅱ.人造地球卫星的结构材料常用镁合金等,金属镁可从海水中提取,工艺流程如图:
(1)粗盐经过溶解、过滤、蒸发后得到的精盐是 (选填“纯净物”或“混合物”)。
(2)反应②的过程是 (选填“放热”或“吸热”)过程。
(3)“母液”中含MgCl2,以上①~④步化学反应中未涉及的反应类型是 。
a.化合反应
b.分解反应
c.复分解反应
d.置换反应
(4)已知某海域海水中总的含盐量约为3.5%,盐中镁元素的质量分数约为3.7%,则海水中镁元素的质量分数约为 (保留两位有效数字),由此可知,用海水晒盐后剩余的“母液”来提取镁,而不直接用海水的主要原因是 。
如图是初中化学常用实验装置(夹持装置已省略)。
(1)仪器a的名称是 。
(2)该装置用于实验室制取CO2:装置甲中发生反应的化学方程式为 。
(3)该装置用于实验室制取干燥的O2:乙中存放的试剂为 。检验丙中气体是否收集满的方法是 。
(4)该装置用于实验室制取干燥的H2:对装置所作的简单改动可以是 。
(5)该装置用于混合物中物质含量测定:在丙装置后连接量气装置,取10.0g黄铜(铜锌合金)粉末于锥形瓶中,加入足量稀硫酸,待完全反应后,根据气体体积换算得到生成的氢气质量为0.1g,则该混合物中铜的质量分数为多少?(写出计算过程)。
如图是实验室制取气体的部分装置,回答有关问题。

(1)指出图中标示的仪器名称:a 。
(2)实验室若选用B装置制备氧气,反应的化学方程式 。收集氧气可选择的装置 (填一个序号)。
(3)实验室制取二氧化碳时,常选用C装置收集气体,证明是否集满的方法是 。
硫化氢(H2S)是一种密度比空气密度大的气体,实验室通常用固体硫化亚铁(FeS)和稀硫酸混合,常温下通过发生复分解反应制得硫化氢气体。试回答:

(1)实验室制取硫化氢气体的化学方程式为 。
(2)根据装置图回答下列问题。
①制得硫化氢气体的发生装置可以选用 (填序号)。该装置在实验室还可以用来制取氧气,写出用该装置制取氧气的化学方程式 。
②若用C装置收集硫化氢气体,进气口应为 (填“a”或“b”)。
根据如图装置图,回答问题。
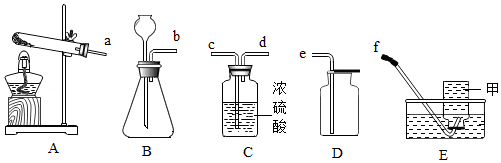
(1)图中仪器甲的名称是 ;
(2)请写出实验室制取二氧化碳的化学方程式 ;
(3)实验室若要制备一瓶干燥的氧气,下列装置的连接顺序正确的是 (填数字序号)。
①b→e
②a→e
③b→d→c→e
④b→c→d→e
如图是实验室制取气体的部分装置,请根据实验装置回答问题:

(1)图中标号仪器的名称是:① ,② 。
(2)用A装置制取氧气的化学方程式为: 。
(3)实验室既可以制取CO2、又可以制取O2的发生装置和收集装置组合为: (在A﹣E中选择)。
(4)实验室通常用澄清的石灰水检验CO2,写出此反应的化学方程式: 。
(5)若用F装置收集一瓶干燥的某气体,则该气体可能是 (填字母代号)。
A.H2
B.CO2
C.O2
根据下列装置,结合所学化学知识,回答下列问题:

(1)E图中仪器①的名称是 ;
(2)实验室制取并收集较纯净的氧气,小华同学已选用A装置作为发生装置,则他还需要选择的装置或仪器有 (填装置序号),该反应的化学方程式是 。小华利用上述收集方法收集到的氧气不纯,导致其不纯的原因可能是 (任写出一点);
(3)实验室利用硫化亚铁固体和稀硫酸混合制取硫化氢气体,通常选择的发生装置是 (填装置序号)。这个反应属于复分解反应,对应的化学方程式是 。
如图是实验室制取和收集气体的部分装置:

(1)实验室用高锰酸钾制取氧气,应选用的发生装置是 (填字母编号),反应的化学方程式是 ,仪器X的名称是 ;
(2)若用E装置收集氧气,气体进入口是 (填“a”或“b”);
(3)在收集了氧气的集气瓶中,进行硫在氧气中燃烧的实验,生成的SO2有毒,为了防止SO2扩散到空气中,可在集气瓶内加入适量的NaOH溶液。发生反应的化学方程式是 (提示:SO2和CO2的化学性质相似);
(4)若用过氧化氢溶液来制取氧气,为了控制反应速率可选择 (填字母编号)作为发生装置。