中国医学著作博大精深,许多化学物质很早就出现在了我国医书中。如李时珍的《本草纲目》中就有绿矾(FeSO4•7H2O)的相关记载。绿矾又名皂矾、青矾,性酸、凉、无毒,主要药用功能是除湿、解毒、收敛、止血。
(1)请写出铁与稀硫酸反应的方程式 。
(2)某实验小组欲用久置的硫酸亚铁溶液制备绿矾(FeSO4•7H2O)晶体,小明同学提出该硫酸亚铁溶液可能变质了,于是进行了以下探究活动:
[查阅资料]
①FeSO4易被空气中的氧气氧化成Fe2(SO4)3而变质。
②Fe2+在溶液中呈浅绿色,Fe3+在溶液中呈黄色。
③Fe3+的检验:向含Fe3+的溶液中滴加无色的KSCN(硫氰化钾)溶液,溶液会变为血红色。
[猜想与假设]猜想1:该硫酸亚铁溶液没有变质。
猜想Ⅱ:该硫酸亚铁溶液已经变质。
[设计实验并验证]
实验操作步骤 |
实验现象 |
实验结论 |
取少量样品于试管中,加入2﹣3滴 溶液 |
试管中溶液变成血红色 |
|
[实验拓展1]下列各组物质在溶液中能大量共存,且形成无色溶液的是 。
A.CuSO4、NH4Cl、Ba(OH)2
B.FeSO4、Na2SO4、KCl
C.FeCl3、NaOH、HCl
D.NaCl、MgSO4、KNO3
[实验拓展2]该实验小组继续查阅资料得知,单质铁能与硫酸铁溶液反应生成硫酸亚铁。于是向上述久置的硫酸亚铁溶液中加入过量铁粉,写出其中的化学方程式 。
金属及其化合物在生产生活中有广泛的应用。

(一)金属的应用和防护
(1)用不锈钢、合成橡胶、氧化镁等材料制造的飞机轮胎属于 材料。
(2)航空煤油是飞机的燃料,它主要是由 炼制的。
(3)铁易生锈,提出防止铁生锈的一种方法 。
(4)特种钢中含有少量Mn、MnO2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为 。
(5)Mg(OH)2受热分解生成高熔点的MgO.Mg(OH)2可用作阻燃剂,其主要原理是 (选填序号)。
a.分解吸热,降低可燃物着火点 b.MgO覆盖燃烧物,隔绝氧气
(二)制备还原性铁粉
实验室利用废铁屑(含少量Fe2O3)为原料制备还原性铁粉的流程如下:
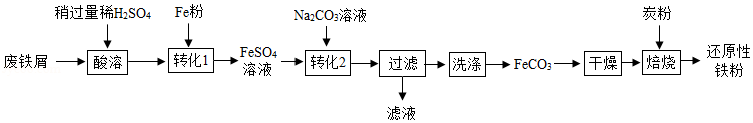
(1)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该反应的化学方程式为 。
(2)检验FeCO3已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加 溶液,无明显现象。
(3)“干燥”时有少量FeCO3发生下列转化:FeCO3 FeOOH+CO2,该转化的化学方程式为 。
(4)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是 。
(三)测定还原性铁粉的组成
还原性铁粉中含有少量FexCy,小组同学在老师的指导下进行以下实验。
资料:①Fe,FexCy在加热时与O2反应能生成相应氧化物。
②FexCy不与酸反应。
实验1:取29.52g样品,加入足量稀H2SO4,充分反应后生成1.00gH2。
实验2:另取29.52g样品,按如图进行实验。
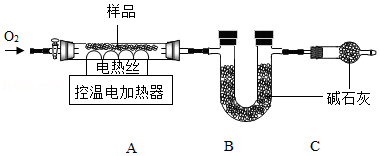
表:装置A和B的质量变化
装置 |
A |
B |
反应前 |
300.00 |
400.00 |
反应后 |
m |
400.44 |
实验后A中固体全部变为红棕色,装置A、B的质量变化如上表。
(1)装配好装置后,实验前先要 。
(2)装置C的作用是 。
(3)FexCy中,x:y= 。表中m的值是 。
反思:若用空气替代O2进行实验,测得x:y的值偏大,可能的原因是 。
人类历史发展的不同阶段曾以不同金属材料的使用作为标志。

(1)金、银在自然界有单质形式存在,说明他们的化学性质都 。
(2)在生产生活实践中,人类逐渐掌握了多种金属的冶炼技术。
①)比较两种铁矿石磁铁矿(主要成分Fe3O4)和菱铁矿(主要成分FeCO3),从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是 。
②近代工业上采用电解熔融氧化铝(A12O3)的方法冶炼铝,Al2O3分解后得到两种单质,该反应的化学方程式为 : 。
(3)镁铝合金被誉为“21世纪绿色金属结构材料”。一种镁铝合金Mg17All2是特殊的储氢材料,完全吸收氢气后得到MgH2和Al,该反应的化学方程式为 。
(4)钛和钛合金是21世纪的重要的金属材料。钛合金制品放在海水中数年,取出后仍光亮如新,是因为其 (填字母序号)非常好。
A.可塑性 B.机械性能 C.抗腐蚀性能
(5)铁在潮湿的空气中反应生成疏松的铁锈。已知:2FeCl3+Fe=3FeC12
①铁锈的主要成分是 (填化学式):将生锈的铁制品放入一定量的稀盐酸中充分反应,变化过程中最多涉及 种化学反应基本类型。
②将10g表面生锈的铁钉(杂质已忽略)浸泡在100g溶质质量分数为7.3%的稀盐酸中充分反应,观察到铁锈已完全消失。反应停止后,取出光亮的铁钉洗涤、干燥、称量,质量为3.6g。则原锈铁钉中铁元素的质量分数为 。
(6)利用“活泼金属”可以制得H2,H2可用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有 (填字母序号)。
A.金属原料的成本 B.生成过程中的能耗和污染 C.金属的回收利用
某课外兴趣小组的同学对二氧化碳的制取和性质进行相关探究。

【实验回顾】
(1)实验室用大理石与稀盐酸制取二氧化碳的化学方程式为 。用向上排空气法收集二氧化碳的原因是 。
【实验探究】
(2)如图1所示,打开汽水瓶盖,有大量气泡冒出,塞上带导管的橡皮塞,导管另一端伸入装有滴加了紫色石蕊溶液的蒸馏水的试管中,轻轻振荡汽水瓶,观察到紫色石蕊溶液变红;加热上述试管,发现溶液颜色由红色变为紫色,写出上述变化过程中反应的化学方程式 , 。
(3)打开汽水瓶盖时,有大量气泡冒出,说明气体的溶解度随 。
(4)如图2所示,在C处放入用石蕊溶液染成紫色的干燥的纸花完成以下实验:
在A处持续而缓缓地通入气体X.当关闭K时,C处的紫色石蕊纸花不变色;当打开K后,C处的紫色石蕊纸花变为红色。
若气体X为未经干燥的二氧化碳,则B瓶中盛放的溶液可以为 (填字母)。
若气体X为未经干燥且混有氯化氢的二氧化碳,则B瓶中盛放的溶液可以为 (填字母)。
A.浓硫酸
B.氢氧化钠溶液
C.饱和碳酸氢钠溶液
【交流反思】
(5)该小组用空气样品和提高二氧化碳含量的空气的样品,控制相同条件测定二者在光照前后温度的变化,实验结果如图3.则与空气样品对应的温度变化曲线是 (填"a"或"b"),二氧化碳可以产生温室效应。

请简述温室效应对人类生存环境的功与过: (各写一点)。
NaOH是重要的化工原料,研究其制备、检验、贮存及应用具有重要意义。
(1)工业上常用电解饱和食盐水的方法制取NaOH,反应的化学方程式为2NaCl+2H 2O 2NaOH+Cl 2↑+X↑.X的化学式为 。
(2)为了探究NaOH样品中是否存在NaCl、Na 2CO 3杂质,设计如下实验方法 
注:AgCl是白色固体,难溶于水和稀HNO 3
①乙中有无色无味气体产生,证明样品中含有Na 2CO 3.产生气体的化学方程式为 。
②试剂X为 溶液;可证明NaCl存在的现象是 。
(3)某兴趣小组试图通过测定生成的CO 2质量,确定因久置而变质的NaOH固体中Na 2CO 3的质量分数,设计了图所示装置并进行如下实验:
步骤一:取一定质量的样品,加入气密性良好的锥形瓶中,然后在分液漏斗中加入足量的稀硫酸,称出装置总质量为m 1。
步骤二:打开分液漏斗旋塞,逐滴加入稀硫酸,待气泡不再产生时,关闭旋塞,称出装置总质量为m 2。

①球形干燥管中不用NaOH固体而用CaCl 2固体的原因是 。
②小明同学认为(m 1﹣m 2)即为生成的CO 2质量,小红同学认为小明的想法不合理,理由是 。
(4)某工厂化验室用20%NaOH溶液洗涤一定量石油产品中残余H 2SO 4,共消耗NaOH溶液20g,洗涤后的溶液呈中性。这一定量石油产品中所含H 2SO 4的质量为 (写出计算过程,否则不得分)。
化学兴趣小组的同学们在老师的带领下走进实验室,开展实验活动。
(1)实验室依次编号为1、2、3、4的药品柜中,分别存放常见的酸、碱、盐和酸碱指示剂。小刚欲使用熟石灰,他需从 号柜中取出。
(2)小刚发现盛放Na2CO3与NaCl两种溶液的试剂瓶标签脱落,为鉴别两种溶液,分别取样于试管中,加入无色酚酞溶液,若为Na2CO3,则观察到溶液变为 色。
(3)小文从柜中取出标有“10% NaOH溶液”的试剂瓶,取少量样品加入试管中,向其中滴入稀盐酸,发现产生气泡,判断该NaOH溶液中有Na2CO3,用化学方程式表示NaOH溶液变质的原因: 。
小文同学对变质的NaOH溶液进行如下一系列实验,实现药品再利用。
I.测定NaOH溶液中Na2CO3的质量分数
[实验操作]取40.0g 10%的NaOH溶液样品进行如图所示的实验。

[数据处理]
①所取用盐酸(溶质质量分数7.3%)的质量理论上不少于 g。
②如图中,反应前后天平示数相差1.1g,计算NaOH溶液中Na2CO3的质量分数(写出计算过程)。
Ⅱ.变质的NaOH溶液再利用
小文将剩余NaOH溶液倒入烧杯中,加入经计算所需的熟石灰粉末,充分搅拌、静置,过滤,得到NaOH溶液和滤渣。充分搅拌的主要目的是 。
(4)实验结束后,同学们将实验产生的废液和废渣倒入指定的烧杯中,得到无色溶液和白色沉淀,溶液中除一定存在的溶质外,可能存在的溶质是 。
同学们再次实验,确认成分后,对废液回收利用,绿色排放。
2019年春节起,常州大部分地区禁止燃放烟花爆竹,开启了龙城环保新时代。
(1)“禁止燃放烟花爆竹”的安全标志是 。

(2)禁止燃放烟花爆竹不仅可以减少噪声污染、火灾等,还以减少SO2和 等空气污染物的排放,提升空气质量。
(3)爆竹中常含有硫、硝酸钾和木炭的混合粉末,点燃后生成硫化钾(K2S)、氮气和二氧化碳,该反应的化学方程式为 。含硫燃料燃烧产生的SO2会形成 型酸雨,酸雨的pH (填序号)。
A.小于5.6 B.等于7 C.大于7
现有一种稀盐酸和氯化铝的混合溶液,取100g该溶液于烧杯中,向其中逐滴加入氢氧化钾溶液,至氯化铝正好完全转化为沉淀,停止滴加氢氧化钾溶液,经测定,生成沉淀的质量为7.8g。请回答:
(1)据观察,产生沉淀前,消耗了一定量的氢氧化钾溶液,请写出该反应的化学方程式 。
(2)100g混合溶液中氯化铝的质量分数是多少?(写出计算过程,计算结果精确到小数点后两位。产生沉淀的化学方程式:AlCl3+3KOH=Al(OH)3↓+3KC1)
现有一种稀盐酸和氯化铝的混合溶液,取100g该溶液于烧杯中,向其中逐滴加入氢氧化钾溶液,至氯化铝正好完全转化为沉淀,停止滴加氢氧化钾溶液,经测定,生成沉淀的质量为7.8g。请回答:
(1)据观察,产生沉淀前,消耗了一定量的氢氧化钾溶液,请写出该反应的化学方程式 。
(2)100g混合溶液中氯化铝的质量分数是多少?(写出计算过程,计算结果精确到小数点后两位。产生沉淀的化学方程式:AlCl 3+3KOH=Al(OH) 3↓+3KC1
现有一种稀盐酸和氯化铝的混合溶液,取100g该溶液于烧杯中,向其中逐滴加入氢氧化钾溶液,至氯化铝正好完全转化为沉淀,停止滴加氢氧化钾溶液,经测定,生成沉淀的质量为7.8g。请回答:
(1)据观察,产生沉淀前,消耗了一定量的氢氧化钾溶液,请写出该反应的化学方程式 。
(2)100g混合溶液中氯化铝的质量分数是多少?(写出计算过程,计算结果精确到小数点后两位。
向盛有Fe2O3粉末的烧杯中加入过量的稀H2SO4,充分搅拌,粉末完全溶解;再向所得溶液中逐滴加入NaOH溶液,生成沉淀与加入NaOH溶液之间的质量关系如图所示。请回答下列问题:
(1)写出AB段内反应的化学方程式: 。
(2)加入NaOH溶液40g时溶液中存在的溶质是 (写化学式)。
(3)计算氢氧化钠溶液中溶质的质量分数。(要求写出计算过程)

化学知识与应用
(1)铝制品耐腐蚀的原因是 (用化学方程式表示);
(2)在牙膏中,常用轻质碳酸钙粉末作摩擦剂。人们通常用下列方法生成轻质碳酸钙:将石灰石煅烧后加水制成石灰乳,净化后与二氧化碳作用得到碳酸钙。试用化学方程式表示上述反应的原理:
① ; ② ;③ 。
2017年4月,“航母”下水,开拓中国新蓝海。
(1)“航母”舰体材料为合金钢,国产航母使用的“超级钢”具有极佳的抗压性、延展性和焊接性。合金钢是 (填序号)
a.合成材料 b.复合材料 c.无机材料
(2)“航母”升降机可由铝合金制造,用石墨作电极在高温条件下电解熔融氧化铝,在阴极和阳极区分别得到A1和O2,阳极区使用的石墨易消耗的原因是 。
(3)“航母”螺旋浆可由铜合金制造。铜合金比铜的硬度 (填“大”或“小”),铜比铁在海水中耐腐蚀的原因是 。
(4)由生铁炼钢时,硅(Si)与氧化亚铁在高温条件下反应生成二氧化硅和铁,该反应的化学方程式为 。

铁及其化合物在生产生活中有广泛的应用。
(一)铁的应用和防护
(1)某麦片中含微量铁粉,食用后铁粉与胃酸反应转化为人体可吸收的铁元素,反应的化学方程式为 。
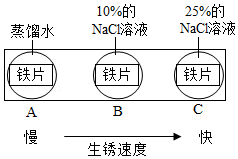
(2)铁锈主要成分是Fe 2O 3•nH 2O,铁生锈主要与空气中的 有关。
(3)如图实验说明NaCl在铁生锈中的作用是 。
(4)铁生锈的次要过程:Fe 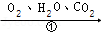 FeCO 3•nH 2O
FeCO 3•nH 2O  FeCO 3
FeCO 3
写出Fe转化为总反应的化学方程式 。
(5)为防止铁生锈,可对铁制品进行"发蓝"处理,使其表面生成致密氧化物(其中Fe、O元素质量比为21:8)保护膜,该氧化物的化学式为 。
(二)废铁的再利用
黄钠铁矾[NaFe x(SO 4) y(OH) z]是一种高效净水剂。用废铁屑(主要成分为Fe,含少量Fe 2O 3和FeCO 3)制备黄钠铁矾的主要流程如图:
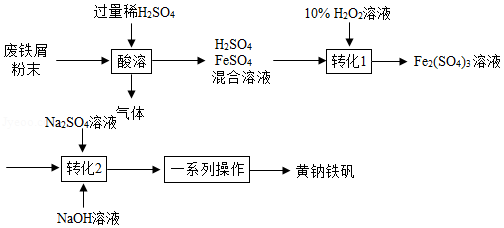
(1)将废铁屑研磨成粉末的目的是 。
(2)"酸溶"时H 2SO 4与Fe、FeCO 3反应,还发生反应的化学方程式有 和Fe+Fe 2(SO 4) 3=3FeSO 4。
(3)"转化1"发生反应的化学方程式为 。反应时温度不宜过高的原因是 。
(三)黄钠铁矾组成确定
称取9.70g黄钠铁矾,用如图装置进行热分解实验。
【资料】
①NaFe x(SO 4) y(OH) z在T 1℃分解会生成H 2O(气态),提高温度至T 2℃继续分解产生SO 3气体,并得到Fe 2O 3和Na 2SO 4。
②浓硫酸可用于吸收SO 3。
(1)装配好实验装置后,先要 。
(2)分别控制温度在T 1℃、T 2℃对A中固体加热。
①控制温度在T 1℃加热,实验后测得B装置质量增加1.08g。
②用D装置替换B装置,控制温度在T 2℃,加热至反应完全。
③T 1℃、T 2℃时,加热后均通入一段时间N 2,目的是 。
(3)反应完全后,将A装置中固体溶于足量水,过滤、洗涤、烘干得4.80g固体,将滤液蒸干得1.42g固体(不含结晶水)。
结论:NaFe x(SO 4) y(OH) z中,x:y:z= 。
反思:若该实验过程中缺少C装置,则x:z的值 (选填"偏大""偏小"或"不变")。